风险管理对于医疗器械的重要性
实施医疗器械风险管理,既是我国医疗器械生产企业必须承担的责任和任务,也是医疗器械监管的重要措施和内容。
国家药品监督管理局于2022年10月发布,并于2023年11月实施的GB/T 42062-2022《医疗器械风险管理应用》(对标ISO14971-2019),预示着新版的医疗器械风险管理标准在国内正式落地,明确了医疗器械风险管理各阶段的要求,总结了各国医疗器械风险管理的经验,并提供了方法指导,对于确保医疗器械的安全有效性,促进中国医疗器械行业的健康发展具有现实而深远的意义。
风险的正确认知
“风险”是损害发生的概率与损害严重程度的结合。换言之,风险由2个部分组成:
一是损害发生概率,即损害发生的经常性、可能性;
二是损害严重程度,即损害所产生后果的严重性。
如坠机事件,经大量资料统计和分析计算,其概率为百万分之一左右,坠机产生的后果是机毁人亡,即损害程度严重。
对于风险,我们应该树立以下观念:
(1)风险是客观存在的,存在于社会实践活动、生产和科学实验中,医疗器械的使用也具有风险;
(2)非正常运行状态下存在风险,正常运行状态下也存在风险,例如:医疗器械在非正常运行或故障状态下存在风险,在使用状态下同样存在风险;
(3)考虑风险时,务必将损害概率和损害程度相结合;
(4)认识风险是为控制和管理风险,并采取措施将风险控制在可接受的水平。
制造商实施风险管理应遵循的工作流程
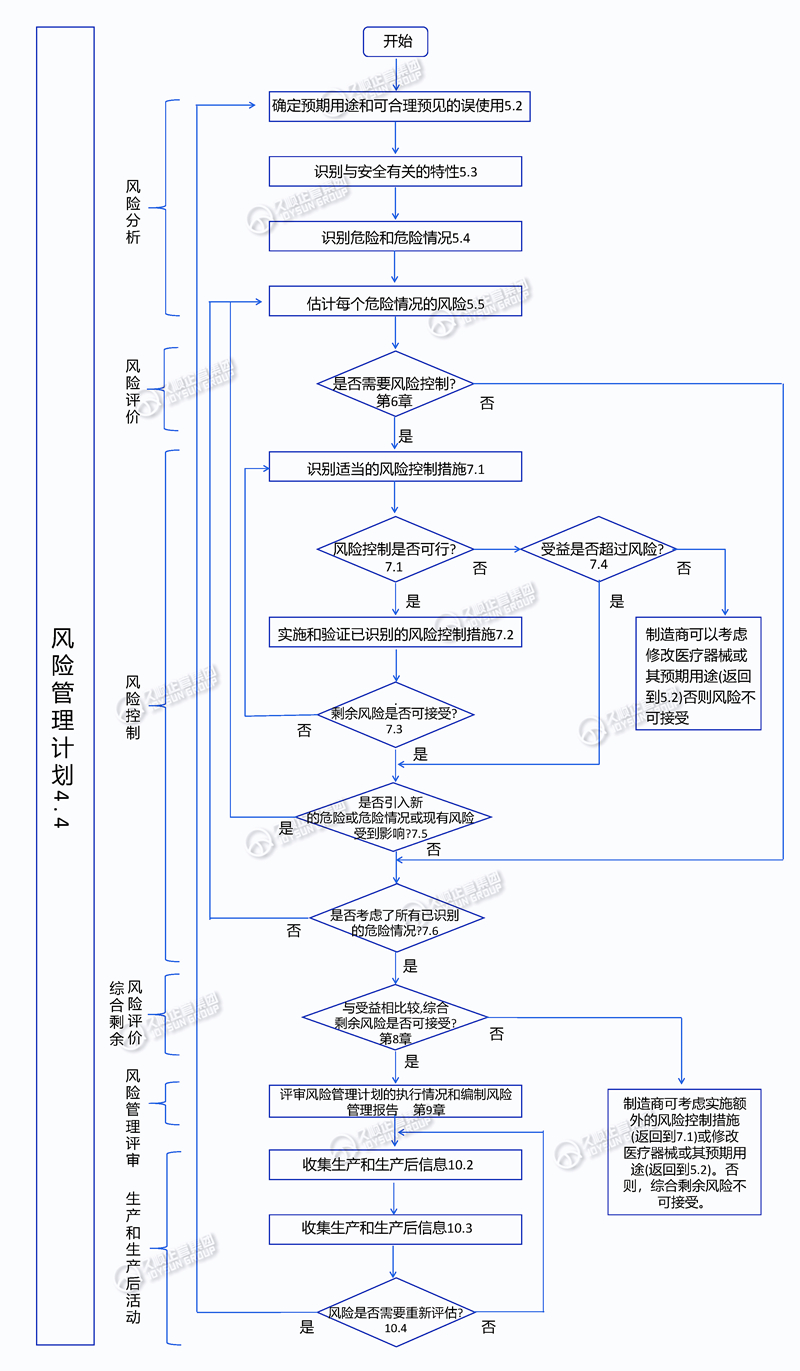
根据上述流程,可帮助了解风险管理每个流程和步骤的要求,从而帮助医疗器械生产企业有效实施风险管理。
→ 建立欧盟ISO13485体系\美国QSR820体系\国内质量管理体系\质量体系培训等,欢迎咨询【久顺】合作!
>> 【久顺企管集团】近30年全球合规技术专家,中国\荷兰\美国\英国均设公司,擅长产品注册、临床研究与临床评价、生产许可证、经营许可证、质量体系GMP等项目与服务,优厚的咨询管理和技术服务经验及能力,深耕无菌、非无菌、植入、有源、体外诊断等医疗器械领域,为产品畅行全球护航。





