大多数无菌医疗器械体系运作中,制造商都会不可避免地面临工艺用水的确认工作,本期就为您带来相关知识科普。
一、工艺用水确认的概念与阶段
通过对制水系统的安装、运行和性能等的验证和确认,用于确保制水系统持续稳定地产出符合标准、满足《医疗器械生产质量管理规范-无菌医疗器械实施细则》要求的工艺用水,并保存制水系统验证计划、方案、报告及再确认等相关技术资料。
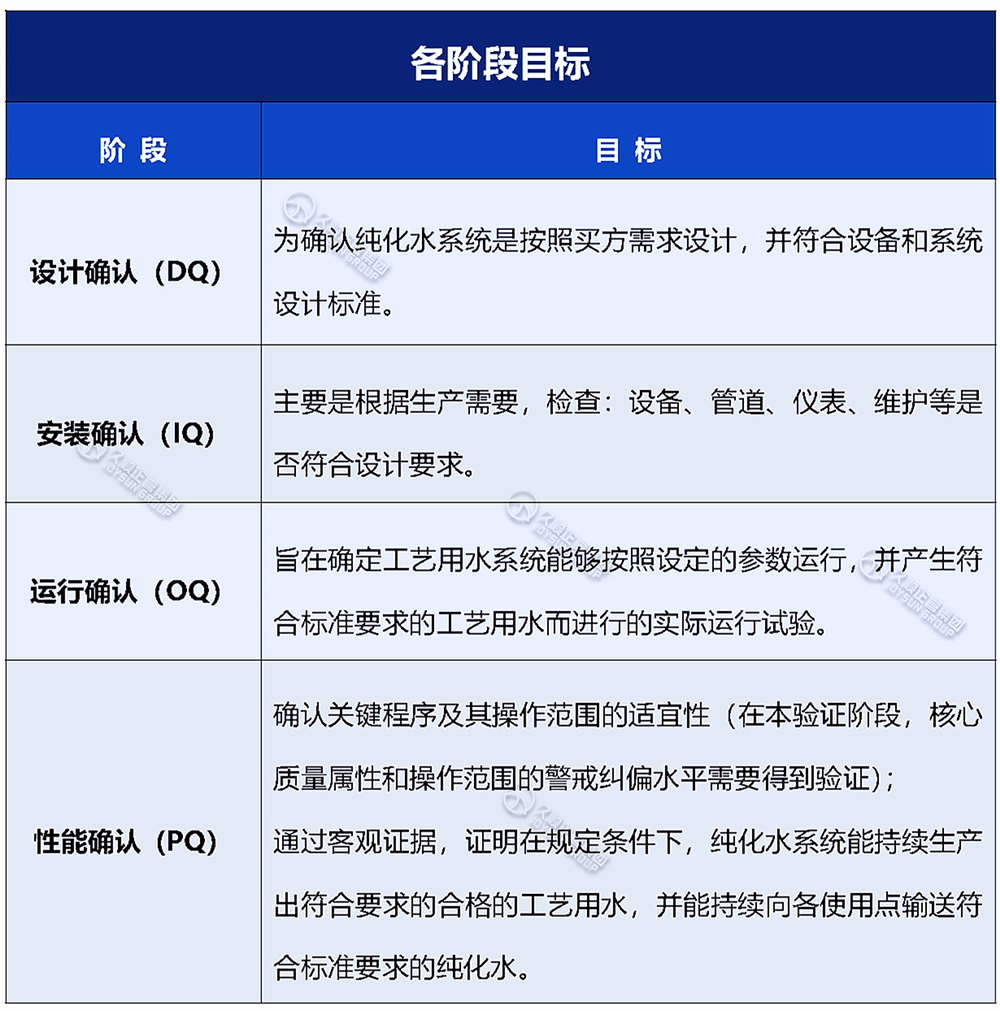
水系统确认主要包括4个阶段:设计确认(DQ)、安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
二、工艺用水再确认的概念与情况
再确认:是指一项生产过程、一个系统(设备)或一种原材料经过验证并在使用一个阶段以后,为证实其验证状态未发生漂移而进行的确认。
需要进行再确认的情况有:
(1)日常生产一段时间后,需要对工艺用水系统进行再确认,可采取对记录数据的回溯和总结的方式对水系统进行再确认。
(2)工艺用水系统搬迁后,需要对其进行再确认。
(3)工艺用水系统在维护、部件更换后,制造商需要记录水质变化情况,并根据该记录进行分析和评价变更部分对工艺用水质量和稳定性的影响;必要时,需进一步开展检测活动和再确认工作。
注意:注射用水正常运行后,一般循环水泵不得停止工作。若停用,则应当在正式生产3周前开启水处理系统并开展3个周期的监控。
如需建立国内质量管理体系\欧盟ISO13485体系\MDSAP\美国QSR820体系\质量体系培训咨询辅导等。
√欢迎联系久顺企管集团合作!近30年全球合规技术专家,中国\荷兰\西班牙\美国\英国均设公司,专注无菌、非无菌、植入、有源、体外诊断等医疗器械领域,对质量体系、临床试验、产品注册及CE/FDA/UKCA/CFS证书,具备丰厚的咨询管理和技术服务经验及能力,护航产品全球畅行无阻。





