1.不符合条件的遗留器械不再享受MDR过渡期
>> MDR法规过渡期延长的时间要求
欧盟《MDR过渡期时间表》提出:2024年5月26日,不满足新过渡期应用条件的遗留器械的过渡期结束;
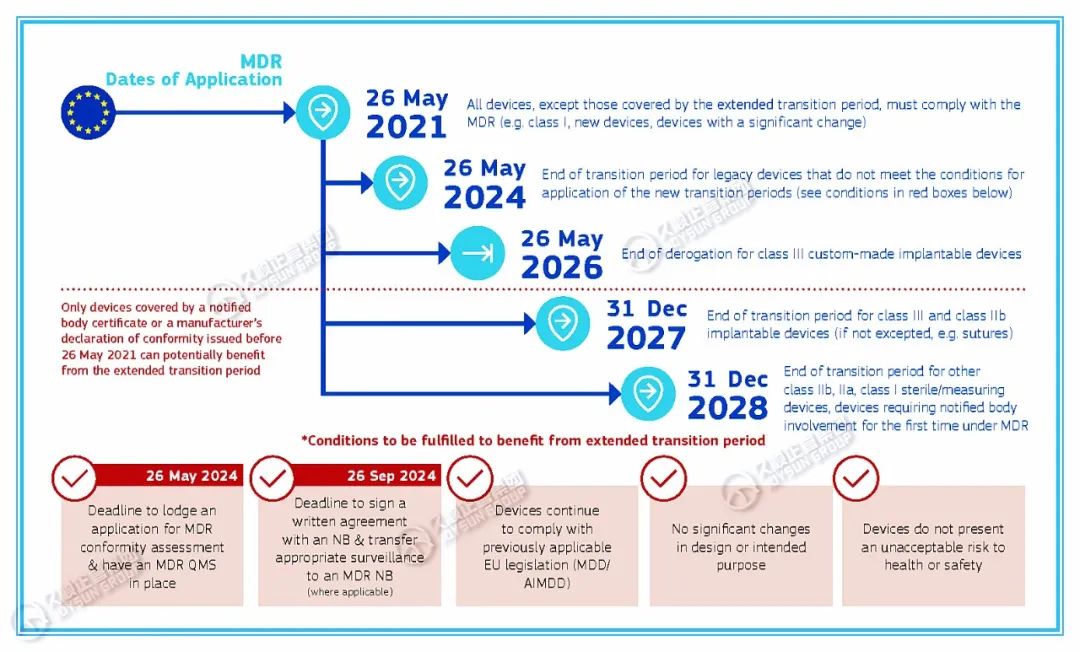
从过渡期延长中受益所需满足的条件有:
·2024年5月26日:提交MDR符合性评估申请并建立MDR质量管理体系的截止日期;
·2024年9月26日:与公告机构签署书面协议并将适当的监督转移至MDR公告机构(如适用)的截止日期;
·器械继续遵守先前适用的欧盟法规(MDD/ AIMDD);
·设计或预期目的无重大变化;
·器械不会对健康或安全构成不可接受的风险。
>> 遗留器械的定义
·在2021年5月26日前,MDD指令下的I类医疗器械已拟订符合性声明,MDR法规下其符合性评估程序需要公告机构参与的;
·在2021年5月26日前,按照MDD指令或AIMDD指令已取得CE标志。
>> MDR法规对质量管理体系的要求
按照MDR要求,制造商需要基于MDR要求建立、运行并保持质量管理体系。
2024年5月26日前,所有遗留器械的质量体系建设必须符合MDR下EN ISO 13485:2016。
针对遗留器械,MDR法规新增许多质量体系要求:包括上市后监督、市场监督、警戒系统、经济运营商和器械登记等,对此制造商最晚不迟于2024年5月26日已建立质量管理体系。
2.仅2个月疯狂新增6家MDR公告机构
·第44家:RISE Medical Notified Body AB(公告机构号:3033),瑞典第2家MDR公告机构。
·第45家:TÜV SÜD Danmark(公告机构号:2443),丹麦第1家、TÜV南德第2家MDR公告机构。
·第46家:AFNOR Certification法标认证(公告机构号:0333),法国第2家MDR公告机构。
·第47家:MTIC InterCert S.r.l.(公告机构号:0068),意大利第11家MDR公告机构,这使得意大利成为拥有最多MDR公告机构的国家。
·第48家:Kiwa Belgelendirme Hizmetleri A.Ş.(公告机构号:1984),Kiwa旗下第3家、土耳其(非欧盟国家)第3家MDR公告机构。
·第49家:QMD Services GmbH(公告机构号:2962),奥地利第1家MDR公告机构。
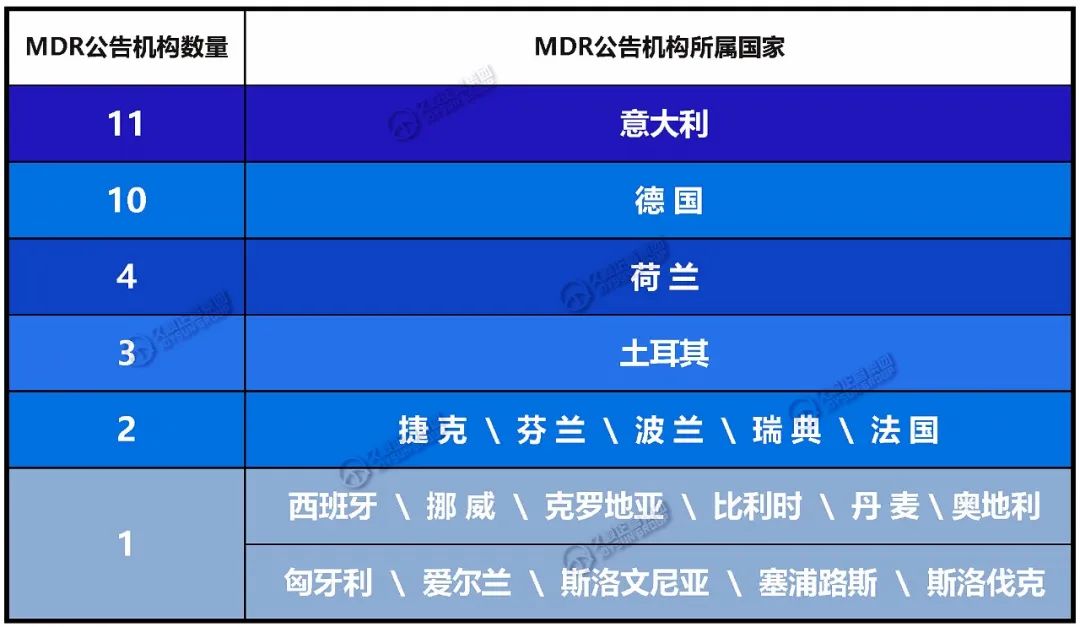
最新的MDR公告机构所在国家分布如下:
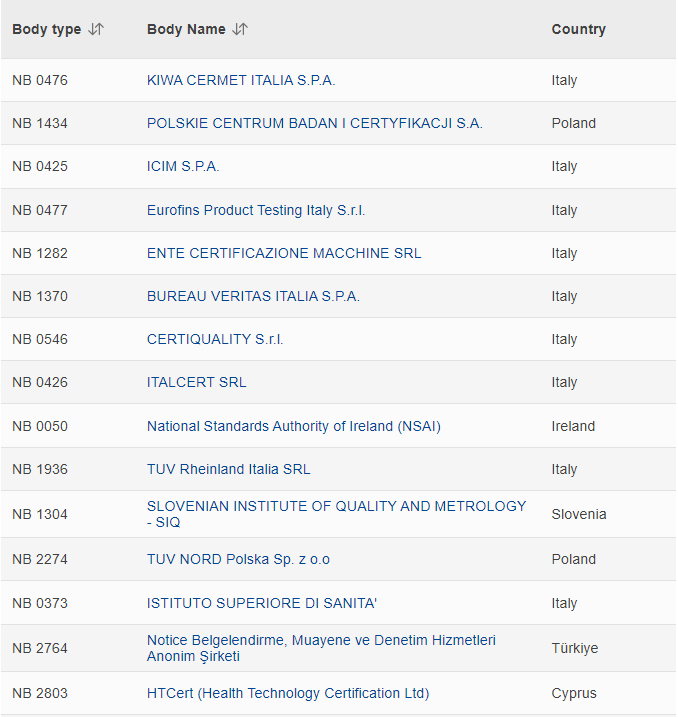
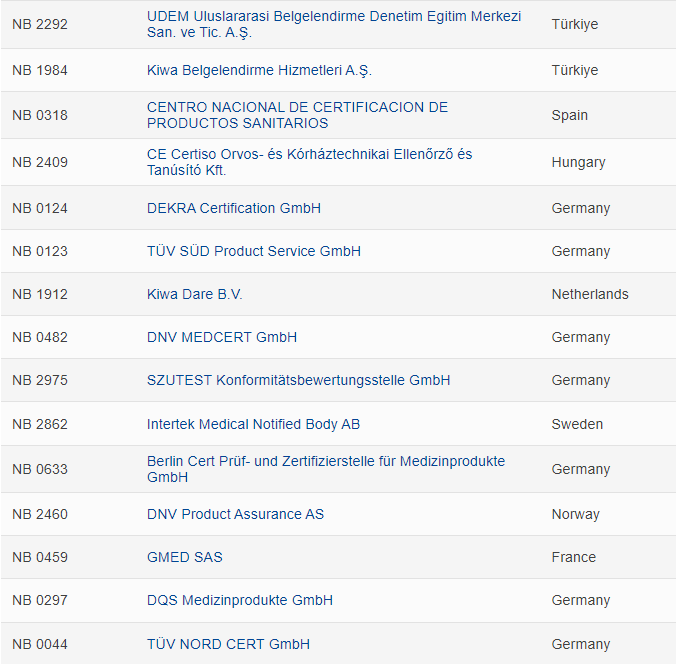
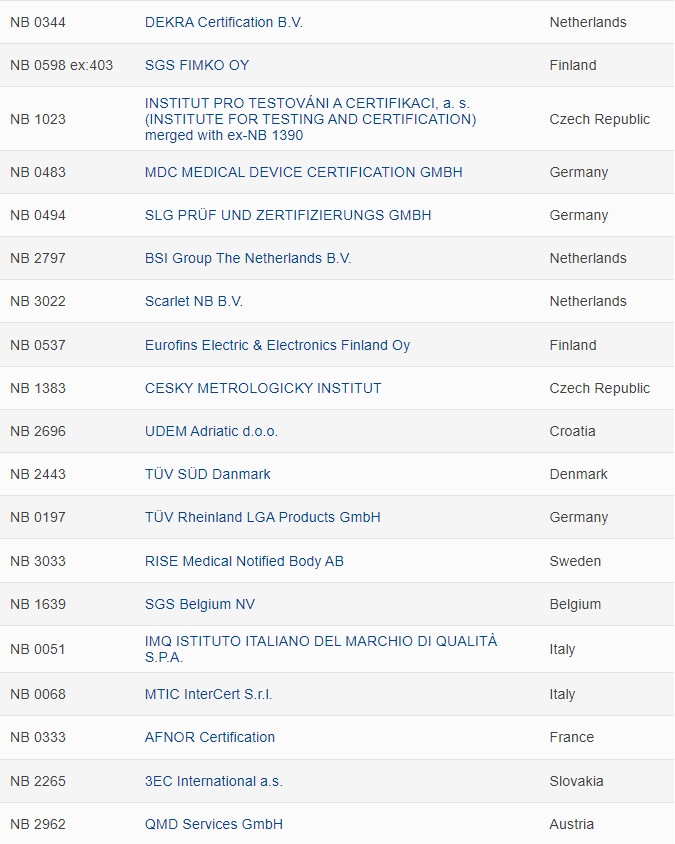
全新的完整版MDR公告机构名单如下:
*MDR公告机构惊人地高速新增,是为何?
MDR/IVDR申请曾面临公告机构资源匮乏导致超85%申请被拒的问题,2024年以来欧盟快速增加6家MDR公告机构,展示欧盟加码发力解决公告机构审核资源不足的坚决性,也向制造商宣告:尽快放心提交MDR CE申请,公告机构审核资源足以承接认证申请。
3.公布《欧盟MDR申请调查结果》
调查数据截止时间:2024年2月29日。
·申请提交与证书颁发的数量:已提交20424份MDR申请,颁发6978份MDR证书;相比2023年10月:MDR申请增加2578份、增幅14%;MDR证书增加1379份、增幅25%。
·MDR申请提交与签约数量的增长:与2023年3月相比,提交申请数量增长73%,书面协议签署数量增长55%。
·MDR申请提交至签约的耗时:从提交申请至签署书面协议的平均时间间隔为1-2个月,在占比62%的大多数情况下,从提交申请至签署书面协议需要少于2个月的时间。
·MDR申请被拒绝的原因:共有454份申请被拒绝,被拒原因中占比最高(55%)为“不在公告机构的指定范围内”,其次为“申请不完整”(占比17%),之后占比由高到低依次为“错误的产品鉴定/设备分类”、“其他原因”、“错误的符合性评估程序”、“公告机构资源不足”。
·MDR公告机构颁发新证书所需的时间:77%为13个月及以上;40%为13-18个月;21%为19-24个月;19%为6-12个月;16%为24个月及以上;5%为少于6个月。
→ 欧盟CE证书办理,快·准·好的秘诀是什么?
√ 答案当然是久顺企管集团!始创于1996年,荷兰\英国\美国\中国均设公司,近30年全球合规技术专家,全程高效的欧盟合规服务:CE注册取证\技术文档编写\合规策略\体系辅导\上市后监督咨询\近20年资深欧代\临床方案设计和临床试验方案等。
MDR CE成功案例(篇幅有限,仅展示部分)↓
☑辅导3H(南京斯瑞奇)取得I类灭菌创口贴的CE-MDR证书;
☑助力海翔药业取得Is类灭菌CE-MDR证书;
☑助力台衡获I类测量CE-MDR证书;
☑辅导亚美斯特(天津)获得IIa类通气类产品的CE-MDR证书;
☑辅导杭州某生物企业成功通过Is类灭菌采样拭子的MDR体系审核;
☑助力深圳客户顺利通过IIa类敷料类产品的MDR体系审核;
☑辅导某跨国医疗器械企业取得IIb类监护类产品CE-MDR证书...





