对于公告机构,制造商会普遍重点关注其MDR和IVDR法规认证能力、双方签署书面认证协议后机构反馈所需的时间,这两项内容同时也是行业市场中极具竞争力的可靠的产能指标。由于CE认证审核周期充满各种不确定性,预计的公告机构反馈所需时间,素来是公告机构不公开的信息。
近日,BSI发布大胆举措,公开其各项认证能力并概述MDR法规和IVDR法规机构反馈所需时间表,并承诺定期更新。
BSI表示,其根据MDR和IVDR法规对医疗器械和体外诊断医疗器械进行的审核已获取更多经验,从而使得审核效率得以提升,并且制造商也愈加意识并掌握到如何顺利完成合格评定过程要求。正是这种趋同协作,促使审核的总体时间表正以肉眼可见的速度缩短。
BSI监管服务部门医疗器械董事总经理Dr Michael Weissig表示:“我们率先发布这些信息,涵盖了所有医疗器械技术领域和相关医疗器械类型和代码。这向医疗器械行业和欧盟监管机构展示了我们致力于提高透明度的承诺,也提高了MDR法规和IVDR法规认证过程的可预测性,让制造商有所期待。”
BSI各项认证审核的机构反馈期限如下:
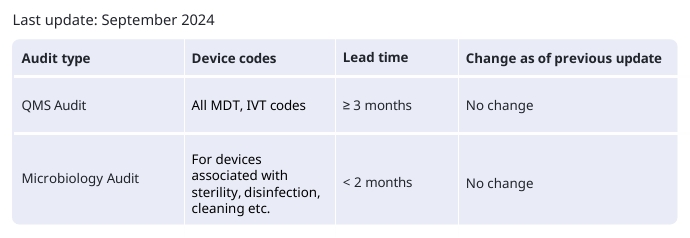
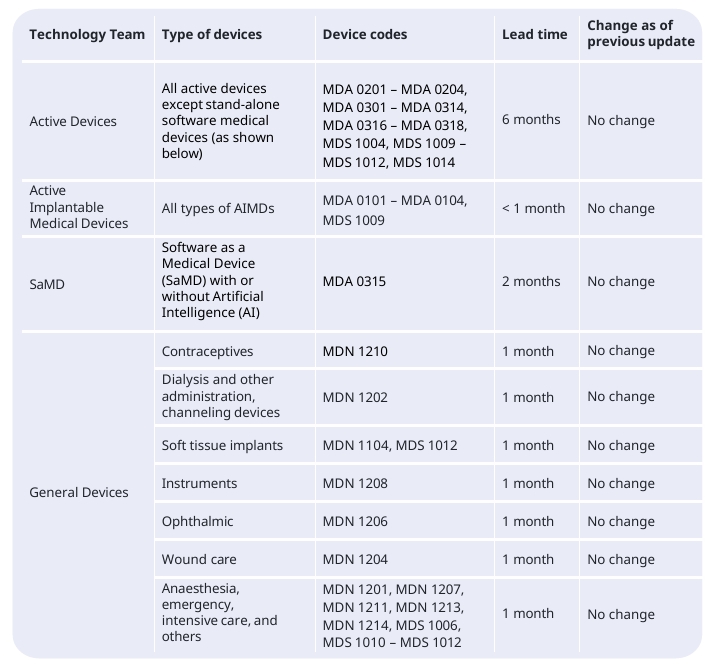
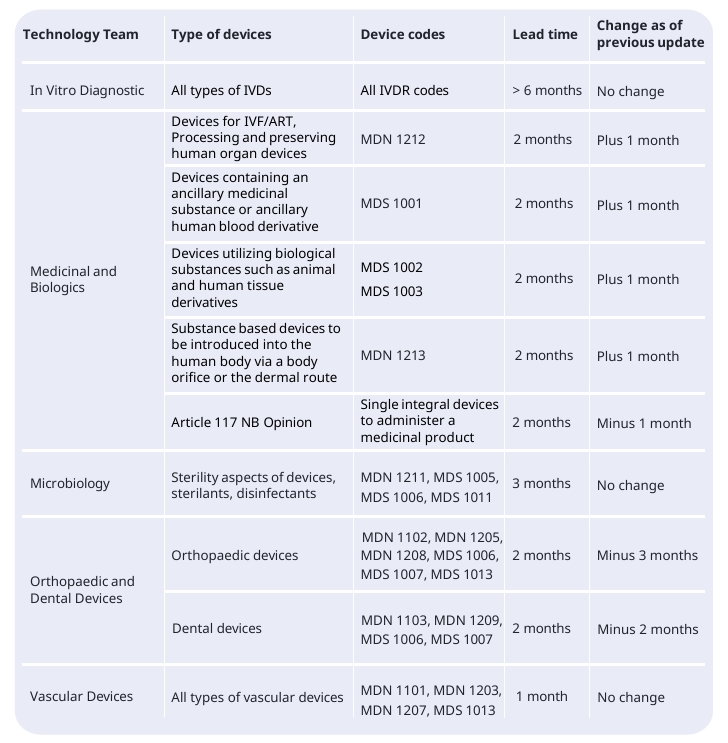
注意:技术文档的评估(从公告机构收到完整技术文档后开始计算的审核平均时间),机构反馈期为1-6个月。
BSI方面还做出说明:具体时间可能会变化,并受到若干因素影响,其中部分因素超出公告机构控制范围,例如:制造商延迟提交已商定的材料、计划变更、申请撤回及最后时刻撤销申请等。
#建立维护ISO13485体系、MDR CE拿证,值得信赖的合规助手是成功关键#
√选择久顺就是选择成功!始创于1996年,西班牙\荷兰\英国\美国\中国均设公司,近30年全球合规技术专家。提供全程高效的欧盟合规服务:√CE注册取证√技术文档编写 √合规策略 √体系辅导 √上市后监督咨询 √近20年资深欧代 √编撰临床方案设计\临床试验方案 √收集\整理\分析试验原始数据并出具临床试验报告等。
以下为久顺部分MDR CE成功案例(篇幅有限,仅展示部分)↓
☑辅导全球医械巨头获IIb类产品CE-MDR证书;
☑辅导斯瑞奇获I类灭菌创口贴CE-MDR证书;
☑助力海翔药业取得I类灭菌CE-MDR证书;
☑助力台衡精密测控获I类测量CE-MDR证书;
☑辅导亚美斯特(天津)获得IIa类通气类产品的CE-MDR证书;
☑辅导杭州某生物企业成功通过I类灭菌采样拭子的MDR体系审核(ISO13485);
☑助力深圳客户顺利通过IIa类敷料类产品的MDR体系审核(ISO13485);
☑辅导某跨国医疗器械企业取得IIb类监护类产品CE-MDR证书...





