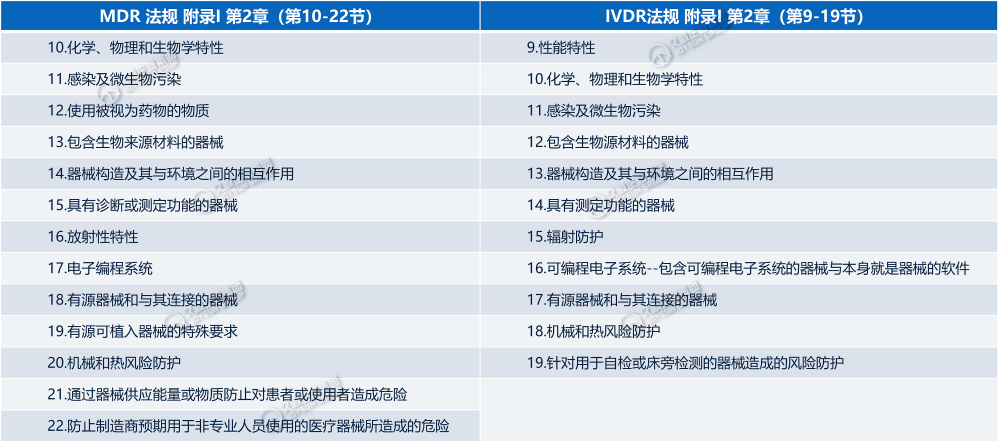
√ MDR\IVDR对GSPR“设计和制造要求”
1. GSPR 10.1:材料的一般考虑
解读1:
■ 概述材料在器械功能、毒性和生物安全方面的基本考虑因素。
10.1(b)考虑到器械预期用途,材料应与身体组织、细胞和体液相容,所列出的许多考虑因素都是已被视为典型的材料特性,应在设计过程中予以考虑。
10.1(c)指出制造商应考虑器械不同部件间的兼容性,应将功能和生物安全的考虑纳入设计开发过程。
10.1(h) 指出应将材料物理和化学表征、生物安全评估的重要性纳入设计开发过程,并作为重要过程。
■ 重点关注有侵入性并与人体直接接触、运输或储存为人体输送药物、体液或物质的器械中,致癌、诱变或生殖毒性物质和内分泌干扰物质的浓度必须低于0.1%。
参考根据欧盟第1272/2008号条例(化学品分类、标签和包装)分类的物质及欧盟第1907/2006号条例(REACH:化学品的注册、评估、授权和限制)或欧盟第528/2012号条例(杀菌产品的市场和使用)中确定的物质。
如果致癌、诱变或生殖毒性物质和内分泌干扰物质(例:铅化合物、其他重金属、酚类、邻苯二甲酸酯)在器械中含量超过0.1%(按重量计),则必须根据10.4.2提出理由。
*以上信息必须在标签上披露,使用说明书中必须包含儿童、孕妇和哺乳期妇女等弱势群体治疗的具体信息。
2. GSPR 10.6:与粒径相关的风险
解读:
■ 制造商应尽可能降低与颗粒大小和性质相关的风险。制造商应特别关注纳米材料,含纳米材料器械的风险等级取决于内部暴露的潜在水平。
■可重复使用器械(如手术器械)的设计应考虑安全清洁、消毒和/或再消毒要求的持续适用。
■ 对具有“特定微生物状态”器械的要求,制造商应澄清、定义和正确验证器械具有不同的无菌保证水平。
■ 对比原MDD/AIMDD,“不可重复使用的包装”内容已被删除。制造商应明确储存和运输条件,确保无菌包装的完整性对最终用户的显而易见,制造商必须考虑包装完整性的清晰度,以防止使用可能被误认为完好无损的破损包装。
3. GSPR 11.5:无菌器械的验证
解读:
无菌器械被要求通过适当、经验证的方法制造和消毒。将“无菌状态下交付的器械”改为“标记为无菌的器械”,可彰显制造商的能力。
无菌器械的最终用户仍需检查和确定包装的可接受性。
此外,标记为无菌的器械还被要求应通过适当的验证方法进行“包装”。
无菌屏障系统工艺的验证属于ISO 13485:2016(第7.5.7条)的规定,引用了涵盖最终灭菌医疗器械包装要求和包装验证的协调标准ISO 11607-1和ISO 11607-2。
4. GSPR 14.2:与环境相互作用的风险
解读:
■ 14.2(b)将“诊断或治疗程序相关的辐射“、“湿度”和“无线电信号干扰”添加到“应尽可能消除或减少的具体风险列表“中。
结合EN 60601-1,电磁医疗产品已考虑包括湿度和干扰在内的环境条件,制造商应设计出能够尽可能降低辐射风险的器械。
■ 明确针对系统和网络级别的软件风险,包括:在软件/产品验证期间考虑最终系统配置,考虑网络安全和网络潜在风险,以及向用户提供信息说明IT网络无法由制造商验证。
NB公告机构已在医疗器械申请中考虑上述内容,本条明确制造商和公告机构必须解决该风险,在风险管理文件中应特别考虑软件和 IT环境之间可能存在的交互风险,以证明符合该要求。
■ 器械的设计和制造应安全有效地进行调整、校准和维护,制造商应该已经将此作为可用性的一部分加以解决。
5. GSPR 14.7:安全处理的设计和制造
解读:
■ 对比MDD/AIMDD此为新要求,要求器械经过专门设计和制造以便于用户、患者或其他人安全处置相关废物。
制造商需要实际确定和测试其器械的处置程序和措施,并在使用说明书中描述前述程序。
6. GSPR 17:电子可编程系统和软件
解读:
■ 17.1和17.2更加明确地包括“本身就是器械的软件”。新增“信息安全”原则,网络安全为新的重点领域,跨多个安全和性能要求。
17.3定义用于移动计算平台软件的具体新要求,制造商应当考虑移动平台的具体特点(包括屏幕尺寸和限制、使用环境中的光线和噪音),制造商可进行可用性测试,以符合本条要求。
17.4针对网络安全和数据保护,增加额外细节,制造商应考虑数据加密、访问级别和用户名/密码格式等。
7. GSPR 22:防止制造商预期用于非专业人员使用的医疗器械所造成的风险
解读:针对非专业人员lay person使用器械提出的具体要求,与之前MDD和AIMDD相比,使用lay person一词为新增。
对以非专业人员为最终用户的器械,本条概述对器械说明、用户技术变化错误和伤害风险及用户验证器械功能的要求和考虑,供普通人使用的器械还对标签和使用说明提出具体要求。
此类器械制造商应提供:NB公告机构希望看到的预期非专业人员的用户需求文件及验证和确认。
GSPR不仅贯穿于医疗器械注册所有环节,更是合规的终极目标,当然也是制造商们面临的一大难题!
欧盟CE技术文档\体系升级想要成功过关?√首选久顺企管!
久顺已为诸多制造商完成MDR/IVDR体系升级、公告机构体系监督审核中的MDR/IVDR发补意见,已建立完备的MDR\IVDR体系升级服务:GAP分析表;上市后监督系统;警戒系统等,具体服务: 上市后监督计划PMS Plan;上市后性能/临床跟踪计划PMPF\PMCF Plan;趋势报告Trends Report;定期安全更新报告PSUR等建立\执行\培训。





