近日,FDA发布《骨科非脊柱骨板,螺钉和垫圈的上市前通知510(k)提交》指南,为不可吸收骨板、螺钉和垫圈器械的 510(k)提交提供建议,适用于骨科骨固定,不包括:脊柱、下颌、颌面、颅和眶骨折固定的适应症。本期解读"510(k)上市前提交建议的条款概述"。

1.使用适应症
应当说明每个主体器械的预期用途/适应症,并应将预期用途/适应症与一个或多个合法上市的器械比较。使用适应症(例:疾病/病症/患者人群)的差异可能会提示要求提供额外信息以支持新适应症。
使用说明书应包括:需治疗的具体解剖位置(如股骨\锁骨\尺骨\腕骨\跗骨),以及器械预期用途(如长骨或短骨骨折固定\小骨碎片或骨折固定\关节固定术或小骨截骨术)。
2.器械描述
以骨板和螺钉为例,可以用表格形式提供概述信息(详见下图)。
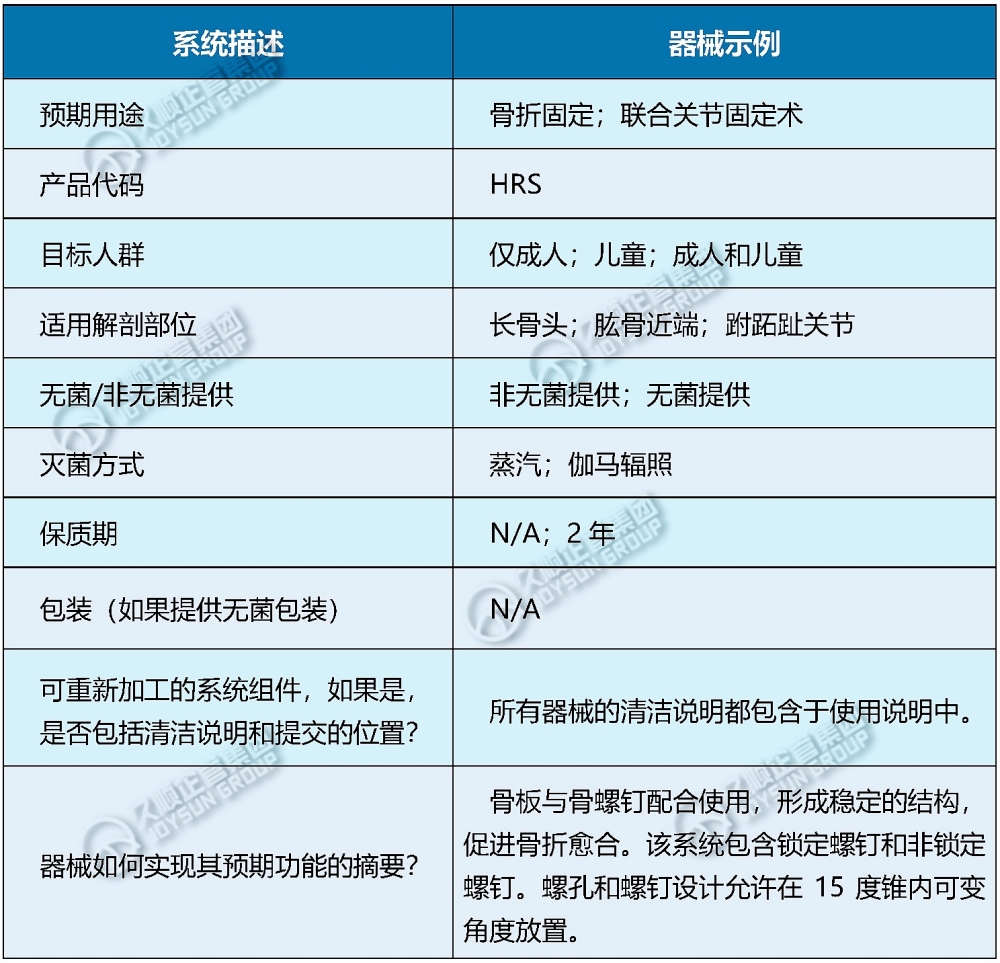
3.器械对比
对根据510(k)流程审查的器械,制造商应将其新器械与类似的合法上市的器械进行比较,以支持其实质等同(联邦食品,药品和化妆品法案(FD&C法案)第513(i)条);
允许制造商采用FDA指导文件“基于安全性和性能的途径”中确定的可选方法,用于证明器械的实质等同,此情况下无需采用等同器械的方式。
4.标 签
骨板、螺钉和垫圈如果作为处方器械,只需符合21 CFR 801.109中条件,就无需再提供21CFR801.109(d)所要求的使用说明,例如:标签应包括医生使用器械的充分信息,包括适应症、效果、途径、方法、给药频率及持续时间、危害、禁忌症、副作用、注意事项。
除21CFR第801的要求外,标签还应包括以下信息:
·器械描述(包括材料和无菌状态);
·器械使用情况(包括一次性使用/可重复使用、预期使用者或特定患者人群);
·禁忌症(例:活动性感染、无法遵守术后负重指示、骨储备不足或血供不良);
·警告(例:儿科器械不得在活性生长板上使用);
·MR安全性信息;
·清洁和灭菌说明(如适用);
·移除说明(尤其针对儿科使用的器械)。
5.无菌
标记为无菌的骨板、螺钉和垫圈,建议按照《上市前通知510(k)中无菌信息的提交和审查》的指导文件提供成品器械信息。
6.再加工(含非无菌和用于无菌加工的一次性器械)
标签中清洁说明应清晰表述其对再处理导致污染的可重复使用器械的适用性,关于如何再加工可重复使用器械或处理提供给用户的非无菌一次性器械的说明,均应包括在标签中。
7.热原性
为解决与细菌内毒素存在相关的风险,提供无菌的骨板、螺钉和垫圈应遵循FDA指导文件《上市前通知510(k)中无菌信息的提交和审查》中概述的建议。
为解决与材料介导的内毒素相关的风险,应遵循FDA指导文件《国际标准ISO 10993-1的使用,医疗器械的生物学评价-第1部分:风险管理过程中的评价和测试》的建议。
对计划标记为“非热原”的器械,建议处理细菌内毒素和材料介导的热原。
8.保质期和包装
无菌提供的器械,应提供包装的描述,包括:如何保持器械无菌性、包装验证测试方法的描述和/或符合相关包装验证测试标准的声明,但无需提供包装测试数据。
包装完整性测试方法建议包括模拟分销和相关包装完整性测试,以及模拟(和/或实时)老化和相关密封强度测试,以验证包装完整性和保质期声明。
建议遵循《ISO 11607-1终端灭菌医疗器械包装-第1部分:对材料、无菌屏障系统和包装系统的要求》和《ISO 11607-2终端灭菌医疗器械包装-第2部分:成型、密封和组装过程的验证要求》中描述的方法。
* FDA注册全能帮手,当然→久顺企管!
【久顺企管集团】近30年全球合规技术专家、资深美代,成员超80%本科、硕士、博士比例,具备海外留学经验,可无障碍英语口语和书面交流,呈献一站式高效率FDA合规服务:法规符合性咨询及培训、证书获取、性能研究方案编写、临床性能方案制定、临床试验实施、FDA验厂 等。
FDA优势服务项目有:
1. FDA官网企业账户的年度注册、产品列名、产品上市前批准(510K、豁免510K),维持企业账户活跃;
2. 邓白氏码查询、激活获取;
3. 产品分类、产品代码的查询配对;
4. 申请创建FDA UDI-DI、GUDID账户;
5. GUDID数据库录入医疗器械关键信息;
6. QSR820体系建立维护、FDA验厂咨询等。





