来源: 本文刊登于《中国医疗器械信息》杂志2018年第3期
作者:李婧1 曾哲2 刘继广2* 彭晖1 徐勤3
单位:1 湖北省医疗器械质量监督检验研究院 (湖北 武汉 430075)
2 国家医用诊断仪器工程技术研究中心技术法规部 (广东 深圳 518057)
3 深圳出入境检验检疫局 (广东 深圳 518057)
内容提要:2017 年5 月5 日欧盟医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)正式发布,于2017 年5 月25日正式生效,并分别于2020 年5 月26 日和2022 年5 月26 日实施。自实施之日起,MDR 和IVDR 将分别取代原欧盟医疗器械指令(MDD)和体外诊断设备指令(IVDD)。文章将对IVDR 法规的变化点进行深度解析。
关 键 词: IVDR 公告机构 UDI
与大部分国家一样,欧盟的监管体系也是呈“金字塔” 式的多层级法规体系: 在医疗领域, 法规层级从高到低依次为法规(Regulation)、指令(Directive)、决议(Decision)等,如图1 所示。
本次新发布的IVDR,在法规层级上从原先的Directive(指令)上升为Regulation(法规),标志着欧盟当局对医疗设备领域监管的进一步重视,同时也预示着在欧盟各成员国内医疗器械监管的尺度将得到进一步的统一[1]。
1.分类规则的变化以及公告机构介入的增加
在IVDR法规中,对于体外诊断设备的监管依然是基于分类监管这个大框架,但是分类规则较原先的IVDD却发生了根本性的变化,即在IVDR中,基于产品的风险将所有的体外诊断设备由低到高分为了A、B、C、D四类,如图2 所示。
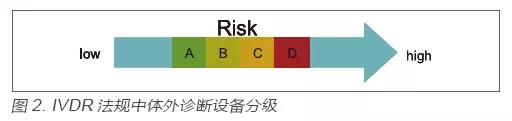
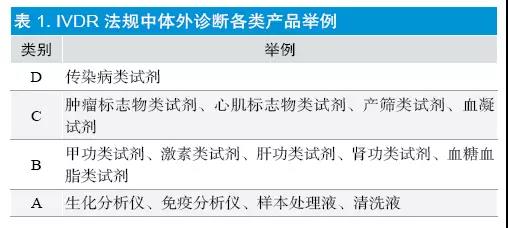
该分类规则来源于全球协调工作组(GHTF),目前加拿大、巴西、澳大利亚等国已使用,是国际范围内认可度较高的分类规则。各类产品举例见表1。
伴随着产品分类规则的调整,各类别产品对应的认证途径自然较原监管体系也有着很大的变化,其中最核心的变化点在于公告机构(Notified Body,NB)介入的增加,涉及产品包括所有的D、C、B类和部分A类。
在整个IVD领域,涉及公告机构介入的产品数量从IVDD监管体系下的10%~20%增加至80%~90%[2]。告机构介入量的增加,意味着绝大多数的体外诊断设备,在欧盟区的市场准入将要告别原先“自我宣称”的形式,取而代之的将是一个实质性的注册过程。
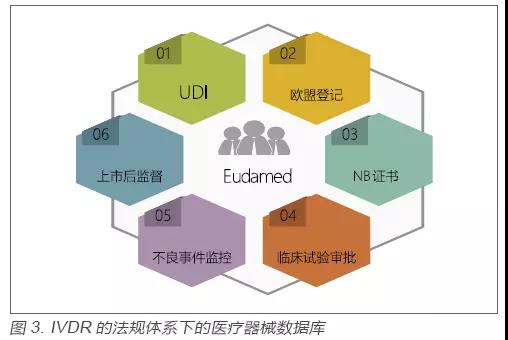
2.欧盟医疗器械数据库的建立以及监管透明度的增加
在欧盟过去十多年的医疗器械监管中,监管的透明度一直是业内诟病比较多的一点。究其原因主要在于没有一个公开的数据库供各方查询[3]。在IVDR的法规体系下,欧盟主管当局一个很重要的工作就是未来将要推出医疗器械数据库(Eudamed),该数据库涵盖从产品上市前审批到上市后监管中的很多重要信息。见图3。
在IVDR中还提出了安全和性能摘要(Summary of Safety and Performance)的要求,以进一步增加监管的透明度。该要求包括C类和D类的产品需要以摘要的形式,将产品规格、性能评估结论及临床试验结论等信息公开。通过该摘要,一方面使用者可以更清楚地了解产品的性能指标,另一方面生产企业可以更加详细地对比同类产品的监管尺度[4]。
3.唯一设备识别系统(Unique Device Identification System, UDI)的引入
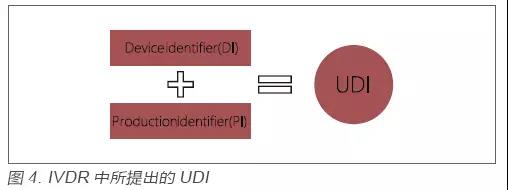
继美国FDA实施UDI的要求以来,世界范围内纷纷效仿,很多国家相继推出相关草案。欧盟本次出台的IVDR,同样也引入UDI的要求,以增强产品的追溯以及上市后的管理。与FDA的要求一样,IVDR中所提出的UDI同样是由一个固定的产品识别码(Device Identifier,DI)和一个非固定的生产识别码(Production Identifier,PI)组成,见图4。生产企业在实施UDI的过程中,需要明确各产品的UDI代码及所包含的信息,并在产品上加贴UDI标贴,同时以电子形式存储UDI相关信息并在Eudamed系统上申报。
4.法规负责人的提出
IVDR法规中,首次提出了法规负责人的要求:要求每个制造商企业内,至少任命一位法规负责人,负责处理与产品相关的监管、合规性相关工作。具体的职责包括产品批放行、起草和维护CE技术文档、完成上市后产品的监控、临床试验相关文件的签署等。
提出法规负责人的要求,标志着新法规IVDR对于执行层面的思考;意味着法规要求在企业内的责任明确、落实到人,从生产企业内部促进着产品的安全性和有效性[5]。
5.过渡期与法规切换
新法规IVDR与IVDD相比变化很大,为避免由于法规切换而造成对现有医疗系统的冲击,实现法规的“软着陆”,IVDR法规从生效(Entry into Force)到实施(Application)期间有5年的过渡期。IVDR法规的生效日为2017年5月25日,实施日为2022年5月26日。在生效日前依照旧法规IVDD颁发的CE证书,在证书有效期内持续有效;在生效日后依照旧法规IVDD颁发的CE证书,在实施日后的2 年失效(若证书有效期晚于该时间点)。见图5。

所以,在IVDD法规框架下“自我宣称”类的产品,由于不涉及CE证书,故需要在实施日前完成IVDR法规的切换;少部分在IVDD法规框架下涉及CE证书的产品,需要在证书有效期内完成IVDR法规的切换,但不得晚于实施之后的2 年。
6.后续
欧盟区是各医疗器械制造商核心目标市场之一,也是全球第二大的体外诊断设备市场。满足IVDR法规的要求对各制造商有着不言而喻的巨大作用,各生厂商在未来的几年内都需要对此开展紧锣密鼓的法规跟踪及实施工作。
参考文献
略
来源:中国医疗器械信息
整理:久顺企管



