尊敬的客户:
诚邀您参加由久顺企管携手BSI和CCBio,举办的《欧盟体外诊断医疗器械法规New IVDR》专题讲座,帮您系统的了解IVDR的法规要求和提升解决实际问题的能力,为以后的IVDR换版带来帮助。
活动背景:
2017年5月5日,欧盟正式发布了全新的体外诊断医疗器械法规IVDR Regulation 2017/746,该法规已于2017年5月25日正式生效。
由于IVDR提出了大量全新的要求,产品分类的改变导致90%的体外诊断医疗器械必须取得CE证书才能在欧盟市场流通,对制造商来说,需要重新了解IVDR法规和整理CE技术文件,无疑是巨大的挑战。
另外,新法规IVDR的颁布,提高了对公告机构的要求,这必将导致审核力度的大大加严。
欧盟是我国医疗器械企业的核心外销市场,满足IVDR法规的要求对各制造商有着非常重要的作用,因此,学习新法规IVDR刻不容缓。
久顺企管携手BSI和CCBio,举办《欧盟体外诊断医疗器械法规New IVDR》专题讲座,帮您系统的了解IVDR的法规要求和提升解决实际问题的能力,为以后的IVDR换版带来帮助。
活动议程 :
| 时间 | 主题 | 演讲嘉宾 |
| 13:20-13:50 | 签到 | |
| 13:50-14:00 | 主持人 | CCBio |
| 14:00-15:30 |
欧盟新IVDR法规介绍 IVDR法规的转版期限 IVDR分类和认证途径的变化 IVDR对质量管理体系的要求 IVDR对技术文件的要求 IVDR对临床的要求 |
计利方 |
| 15:30-16:30 |
取得IVD产品的CE证书和ISO13485证书的途径 ISO13485如何符合CE-IVDR的要求 CE-IVDR对质量手册的要求 CE-IVDR对程序文件的要求 CE-IVDR对SOP文件的要求 CE-IVDR对质量记录的要求 IVDR和IVDD的主要差别 IVDR法规负责人的要求 上市后监管的要求 如何做好过渡期的准备工作 |
宋福明专家团队 |
| 16:30-17:00 | 答疑 |
时间/地点:
·时间:2018年9月25日(周二) 14:00-17:00
·地点:上海浦东新区巴圣路160号上海自贸壹号科技产业园培训中心
·费用:免费
·参会人员:体外诊断相关从业人员
·额外福利:我们将为参与者提供精美茶歇和小礼品
交通攻略:
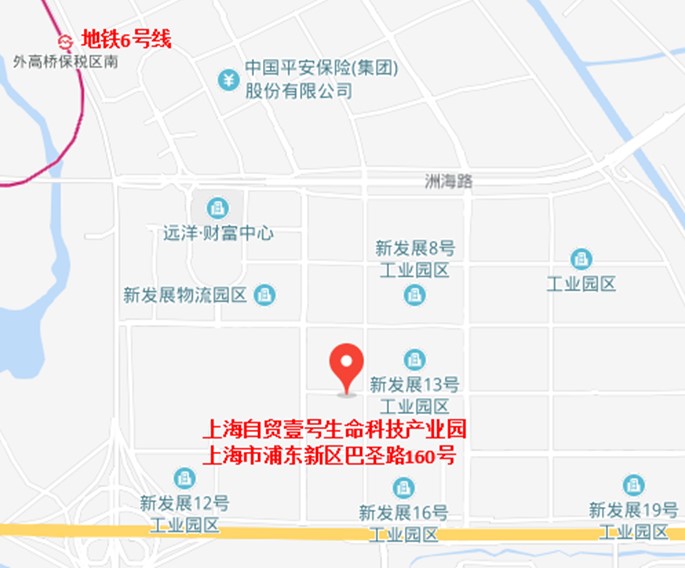
上海市浦东新区巴圣路160号 上海自贸壹号生命科技产业园
地铁路线:搭乘地铁六号线至外高桥保税区南站1号出口,CCBio将安排商务车送您至活动现场
自驾车:活动方提供免费停车位
报名:
·手机报名:132-6259 9339
·电话报名:021-5860 0042
·邮件报名:snm88@isosh.com
·微信报名:扫描二维码关注 “久顺集团技术服务”
·联系人:宋先生

感谢您的参与,谢谢!



