
在欧盟MDR法规中,如何理解PSUR?

Periodic safety update report (PSUR) 又称为“定期安全性更新报告”,在MDR2017/745 Article 86中对此进行了详细的描述。
一.什么是PSUR?
对于IIa、IIb和III类医疗器械制造商,应建议定期安全性更新报告,以此来汇总(按照MDR附录III)收集到的上市后监督数据的分析结论以及任何采取的纠正预防措施的描述。
二.PSUR需要涵盖哪些内容?
-
收益/风险的结论;
-
使用该器械人口数量和特点;
-
产品销售数量;
-
器械的使用频率;
-
上市后临床跟踪的主要发现
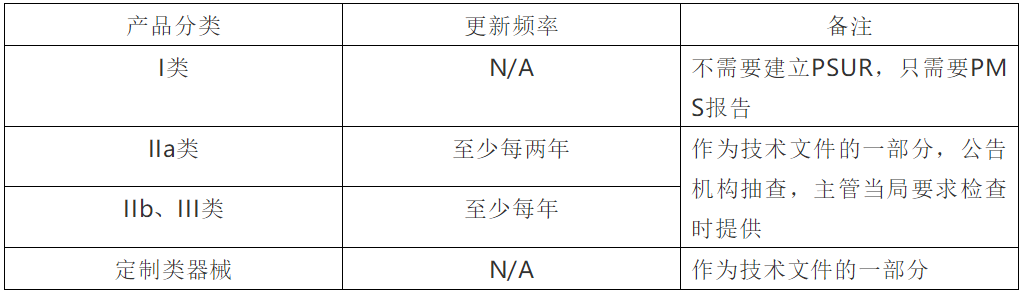
三.PSUR对于不同分类的产品,所对应的不同要求:
久顺企管集团(中国 英国 荷兰 美国)为您提供快捷、专业、优质的取证服务。若您有新冠试剂盒、口罩、防护服、护目镜等产品需要出口,久顺为您提供的服务包含:
欧盟:
ISO13485质量体系、CE认证(MDD/MDR/IVDD/IVDR)、欧盟授权代表(EAR)、英国授权代表、荷兰注册(CIBG)、英国注册(MHRA)、自由销售证书(CFS)
中国:
质量体系GMP、临床试验、医疗器械应急审批、办理产品注册证、生产许可证和经营许可证;
美国:
FDA注册、美国授权代表、美国FDA EUA注册、NIOSH认证、美国FDA-QSR820验厂;
其他:
MDSAP单一审核、使馆公证、商会公证和海牙公证等。
联络手机:132-625-99339
免费电话:400-658-3933
我们恭候您的来电咨询!



