行文目的
医疗器械临床评价,是指运用兼具科学性与合理性的方法,评价和分析临床数据,为确认医疗器械在适用范围下的安全性、临床性能、有效性,而持续性开展的活动。
在医疗器械注册中,少不了临床评价报告。
而临床评价并非一步就位,需持续开展、在医疗器械完整生命周期中贯穿始终。
医械合规有如棋局,在博弈之中取得进步,例如:是否开展临床评价?临床评价开展应走哪种路径?
带着上述问题,久顺为您开启临床评价这盘棋。
一、免于临床评价的医疗器械
参见《免于临床评价医疗器械目录》。
对于列入《目录》产品,注册申请人需提交:
- 申报产品相关信息与《目录》所列内容的对比数据;
- 申报产品与《目录》中批准的境内已注册医疗器械的对比说明。
提交的上述材料:
√ 应能证明申报产品与《目录》所述产品基本等同。
× 如果无法证明,应进行临床评价。
二、医疗器械开展临床评价的2条路径
《医疗器械监督管理条例》规定,医疗器械临床评价可根据 产品特点、临床风险、现有临床数据 等情况,通过开展临床试验,或通过分析评价同类型医疗器械的临床文献和临床数据,以证明医疗器械的安全性和有效性。
1.临床评价的2条路径选择
①注册申请人可参考《决策是否开展医疗器械临床试验技术指导原则》,以确定是否开展临床试验。
②结合国家食品药品监督管理局技术审评中心发布的:“《医疗器械分类目录》子目录相关产品临床评价推荐路径”公告,选择合适的临床评价路径。
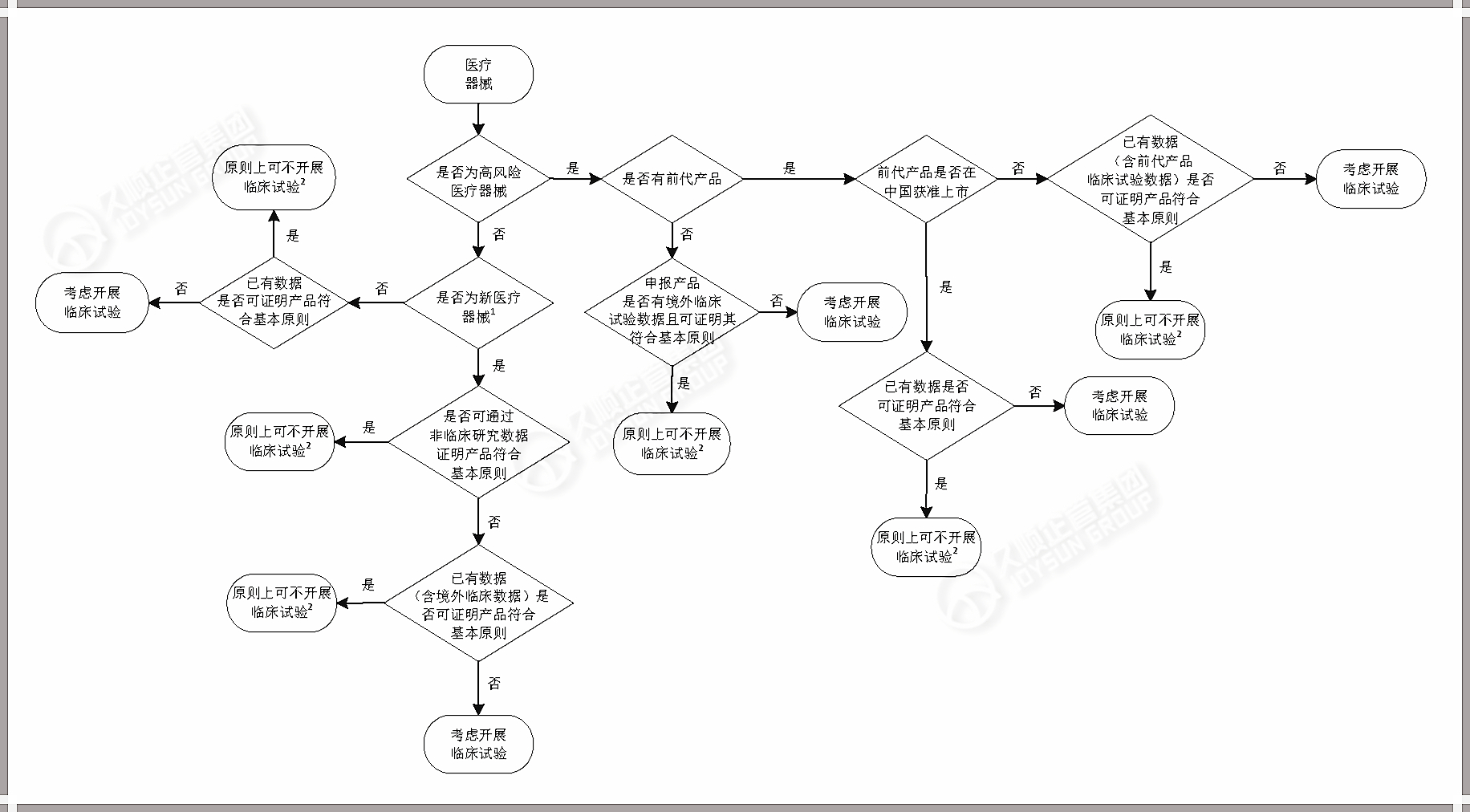
2.临床试验开展与否的决策流程
决定是否开展医疗器械临床试验时,应综合考虑产品的 适用范围、技术特征、生物学特性、风险程度和现有研究数据(包括临床数据和非临床数据)。
下图,可用于考虑 >> 是否开展医疗器械的临床试验?
3.临床评价等同性论证的路线图
如果根据等同器械的临床数据进行临床评估,则需要进行等同性论证。
等同性论证:是指将申报产品的技术特性、生物学特性,与适用范围相同的对比器械进行比较,以证明二者基本等同的过程。
基本等同包括2种情况:
①申报产品的适用范围、技术特征和生物学特性与对比器械相同;
②申报产品与对比器械具有相同的适用范围、相似的技术特性和生物学特性;有充分的科学证据证明:申报产品与对比器械具有相同的安全性和有效性。
可根据下图描述的步骤进行等同性论证:
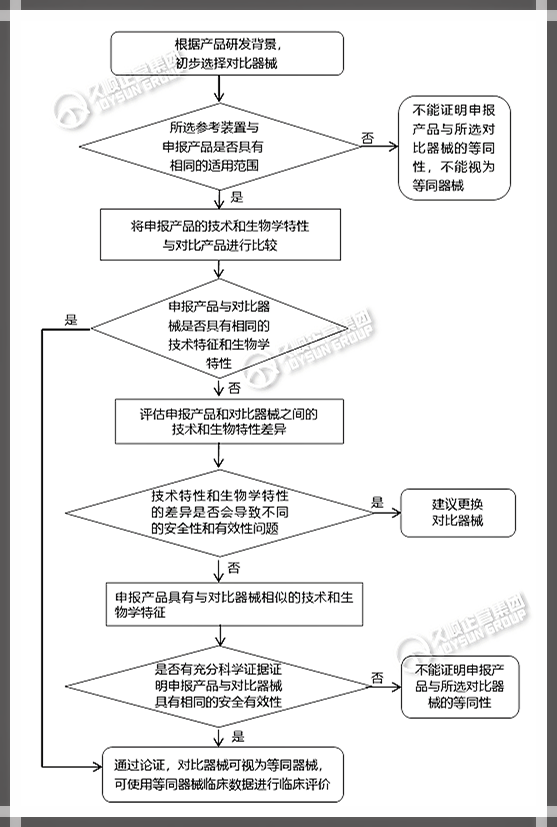
提示:如果已建立申报产品与对比产品间的等同性,则等同器械的临床数据可用于临床评估。
三、观点总结
作为医疗器械技术文档的组成部分,医疗器械注册申请人应严格符合相关法规要求,将相关文件用于临床评价之中。
# 技术文档编制(含临床评价报告)如何保障专业又高效? #
>> 交付【久顺企管集团】即可!
→ 近30年合规技术专家,擅长产品注册、临床研究与临床评价、生产许可证、经营许可证、质量体系GMP等项目与服务,具备优厚的咨询管理和技术服务经验及能力,深耕无菌、非无菌、植入、有源、体外诊断等医疗器械领域,中国\荷兰\美国\英国均设公司,护航产品全球范围畅行无阻。






