1. 临床性能数据有哪些选项?
根据IVDR法规第2(41)条定义,临床性能是指“根据目标人群和预期用途,器械产生与特定临床状况\生理\病理过程或状态相关结果的能力”。
按照此定义,临床性能有3种选择:
A.定义为与临床状况/疾病相关的临床性能:测量临床状况或疾病相关的特定分析物并具有医疗决策点的器械,需要临床性能数据和相应的临床性能报告;
B.定义为与生理\病理过程或状态相关的临床性能:测量分析物的器械,无明确的医疗决策点或测量与临床状况无关的分析物的器械,可将临床性能定义为与生理\病理过程或状态的相关性,或可考虑遗漏临床性能数据的理由;
C.无正当理由的临床性能数据,可能发生于如此情形:对于无分析或临床性能或特定性能要求的器械。
2. 临床数据如何证明“临床证据”?
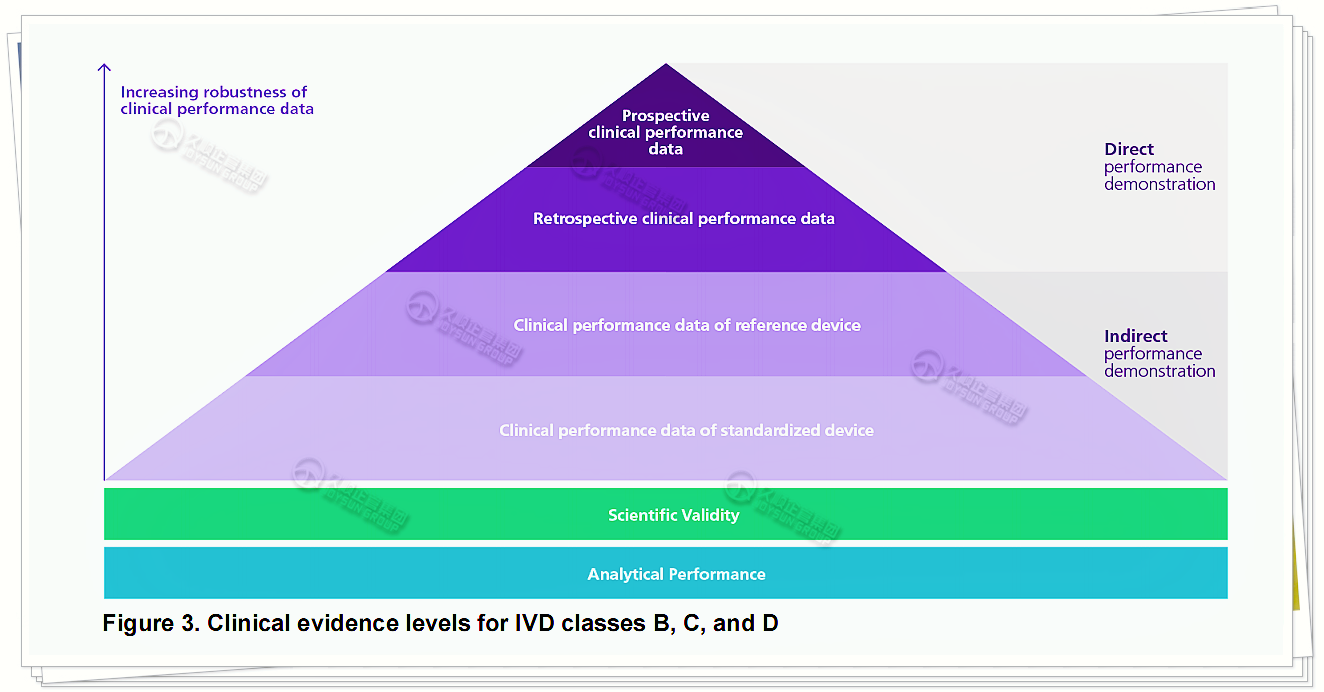
2.1直接和间接证明数据
临床性能的直接证明数据,通过对前瞻性采集的样本或生物库/剩余样本的研究获得。
间接证明数据,则源于文献检索或与对比器械的比较。
相比间接证明数据,直接证明数据产生更强的临床性能数据证据水平,因此应适用于更高风险等级和/或新型器械。
2.2 临床性能指标和研究终点
明确定义预期目的/用途,是确定临床性能指标和相应研究终点或数据类型的第一个重要步骤。
具体而言,预期用途中的临床功能定义了临床性能指标、研究终点和数据类型,例如:声称诊断预期用途的测试的诊断敏感性和特异性,以及声称预测预期用途的测试风险比。
此外,器械的预期用途和目标人群也定义了IVD产品的风险等级。
2.3 前瞻性研究与回顾性研究
·最有力的临床性能数据,来自具备充分统计支持的前瞻性临床性能研究;
·回顾性研究,通常使用代表预期用途/使用人群的生物库或剩余样本、必要的临床数据,以确定临床表现。
相比前瞻性研究,回顾性研究可能导致更大的偏差(选择偏差、医疗实践的变化等),因此,回顾性临床性能研究可能更适合于成熟器械。
· 如果对比器械的临床性能已知并已发布,则可使用比较研究以显示临床性能,通过同时使用标准化物质和参考物质进行分析性能测定,获得的数据可间接证明产品临床性能。
3. 使用直接证明数据作临床性能研究时,目标人群应如何定义?
·根据IVDR附录I,测试或目标人群被指定为器械预期用途的一部分,例如:制造商在产品设计开发过程中,应包含确定测定检测阈值的方法,其中包括目标人群周边的考虑因素。
·制造商对计划开展IVDR-CE认证的产品,其临床性能研究对象必须是:器械最终的目标/测试人群的代表性样本。
·ISO20916提供了临床性能研究考虑因素的设计方法,其中包括考虑目标人群。
·目标人群的示例包括:年龄、种族、性别、地理位置、临床状况和治疗状态。考虑到地理因素,制造商应检查:使用数据时是否需考虑欧洲医学会发布的临床指南?
4. 欧盟以外临床数据可否用于欧盟器械性能评估?
如今,欧盟以外临床数据用于欧盟市场器械的性能评估,是普遍性做法,经常发生于这样的情形如:器械引入欧盟市场前,已投放至非欧盟市场,而为支持该器械所收集的证据通常基于欧盟以外所开展研究。
公告机构甚至主管当局都有鼓励措施,允许制造商在欧盟以外收集的临床数据用于欧盟临床数据,原因如下:
1.减少性能研究的重复;
2.使患者更快使用新的诊断工具;
3.避免开发资源的浪费。
久顺提示>> 欧盟以外的临床数据需满足当地监管要求,同时符合欧盟伦理标准时,才能被使用。
临床研究·久顺出品,靠谱✔可信✔
→ 欢迎联系【久顺企管集团】,始创于1996年,中国、荷兰、英国、美国均设公司。
>> 近30年全球合规技术专家,呈献全程高效的欧盟合规服务:
√ 欧盟CE注册取证;
√ 技术文档编写;
√ 合规策略;
√ 体系辅导;
√ 上市后监督咨询等。
√ 近20年资深欧盟授权代表;
>> 已成功布局欧盟临床试验渠道,提供欧盟临床试验一站式CRO服务:
√ 临床方案设计、临床试验方案的撰写;
√ 与当地实验室/医院合作,安排客户试验产品合规开展临床试验;
√ 包括但不限于:收集\整理\分析试验原始数据并出具临床试验报告。





