“软件Software”被定义为:一组处理输入数据并创建输出数据的指令。
软件遇上医疗器械后,“医疗器械软件(MDSW)”则是:旨在单独或组合用于医疗设备法规或体外诊断医疗设备法规中“医疗器械”定义中规定目的之软件。
本期,久顺企管步步为营、稳扎稳打,为你将医疗器械软件的认定路径娓娓道来......
一、欧盟医疗器械软件MD MDSW认定5步法
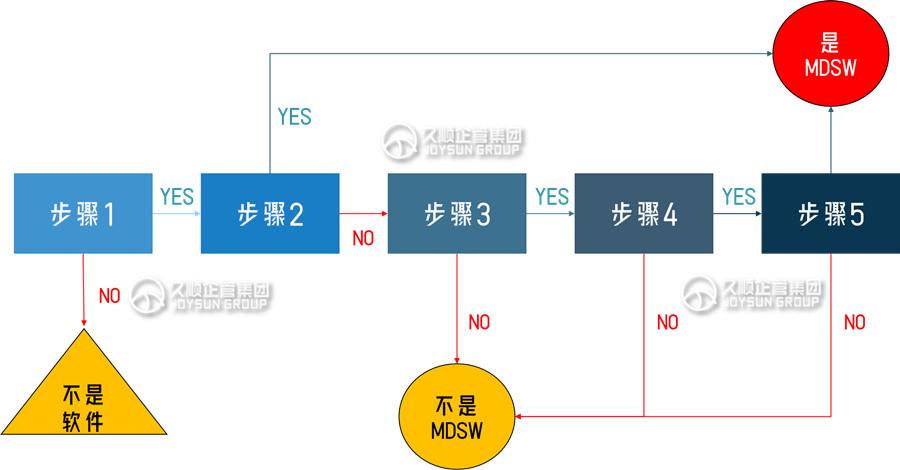
步骤1:
如果产品符合软件定义,则可能是MD MDSW,继续执行步骤2;
如果不符合定义,则不是MDSW,但软件仍可能适用医疗器械法规。
步骤2:
如果产品属于MDR附录XVI器械,或属于医疗器械附件,或是驱动或影响医疗器械使用的软件,则必须在其监管过程中被视为该器械一部分,若属于附件,则必须被视为独立器械。如果不属于前述情况,则继续执行步骤3。
步骤3:
如果该软件确实对数据执行了操作,或执行了存储、归档、通信、简单搜索、无损压缩(即允许使用精确重建原始数据的压缩程序)以外的操作,则可能是医疗器械软件,继续执行步骤4。
步骤4:
软件的预期用途是为了个别患者的利益吗?
若答案为是,则继续执行步骤5。
并非为个别患者利益设计的软件,例如:仅用于汇总人口数据,提供一般诊断或治疗途径(不针对个别病人)、科学文献、医学地图集、模型和模板,以及仅用于流行病学研究或登记的软件。
步骤5:软件是否符合医疗器械软件(MD MDSW)的定义?
二、欧盟体外诊断医疗器械软件IVD MDSW认定3步法
· 如果制造商计划将软件与体外诊断医疗器械一同使用,并能遵照其预期用途,则该软件属于体外诊断医疗器械范围,并应单独作为体外诊断医疗器械软件IVD MDSW处理。
· 如果软件驱动或影响到器械(硬件)的使用时,应将该软件视为受驱动或受影响的器械(硬件)并接受相应监管,若前述器械属于IVD,则该驱动软件为IVD MDSW,同理可得:若前述器械属于MD,则该软件为MD MDSW。
例:分析解释酶联免疫吸附试验(ELISA)读取器传递的光密度、印迹的线或点模式的软件,该软件获取原始数据输出,并将临床算法用于诊断和/或预后目的,在此情况下,其有资格作为IVD MDSW。

步骤1:
软件能否提供体外诊断医疗器械定义范围内的信息?
符合法规(EU) 2017/746-IVDR第2(2)(a)至(f)条所列信息的软件,可作为体外诊断医疗器械软件IVD MDSW,具体情形如下:
A.有关生理或病理过程或状态(调查该过程或状态);
B.诊断涉及先天身体或精神缺陷;
C.诊断易患某种病症或疾病的体质;
D.确定对于潜在用户的安全性和兼容性;
E.预测治疗反应;
F.确定或监测治疗措施。
若软件提供如下信息,并且符合(EU)2017/745第2(1)条定义,则可作为MD MDSW:
G.疾病的诊断、预防、监测、预测、预后、治疗或减轻;
H.对伤害或残疾的诊断、监测、治疗、减轻或补偿;
I.解剖或生理或病理过程或状态的调查、替代或修改;
J.控制或支持受孕;
K.专门用于第1(4)条和附件十六所述器械的清洁、消毒或灭菌的产品。
步骤2:
软件是否仅以体外诊断医疗器械所得数据为基础创建信息?
如果所提供信息,仅以体外诊断医疗设备获得的数据为基础,则该软件属于体外诊断医疗设备,也是IVD MDSW。
如果该数据信息,从体外诊断医疗设备与医疗设备的组合中获得,则继续执行步骤3。
步骤3:
预期目的实质是由体外诊断医疗设备数据源驱动吗?
如果是,则适用的法规为条例(EU)2017/746,可作为IVD MDSW。
如果预期目的主要由来自医疗设备的数据源驱动,则适用的法规为(EU)2017/745,可作为MD MDSW。
如果输出数据的预期用途,同时满足MDR和IVDR规定的医疗器械和体外诊断医疗器械定义的情况(请参阅步骤2),应根据信息对实现预期用途的重要性,对数据源进行加权,以帮助制造商确定所适用的法规。
#如何从容应对欧盟医疗器械监管?#
→【久顺企管集团】值得您托付!始创于1996年,荷兰、英国、美国、中国均设公司,近20年资深欧代、近30年合规技术专家,集合呈献一站式快捷合规服务:MDR/IVDR技术文档编写、产品注册、欧代、体系辅导等。
>> 久顺技术团队每日无缝链接欧盟实体实时信息,深谙欧盟法规,辅导企业升级体系以满足MDR\IVDR合规性,帮助企业短时间内建立运行质量管理体系,编写技术文档,辅导通过公告机构审核,快捷获取CE证书,是企业产品入市欧盟的加速引擎。





