不少医疗器械生产经营企业或使用者存在这样的现象:更注重器械的质量控制,却轻视了医疗器械标签的规定。
其实,医疗器械标签是展现医疗器械安全性、有效性、主要技术特征等信息的重要载体,未规范标注标签可能为医疗器械使用者带来用械安全的隐患,而器械的相关生产经营企业也可能因此受到处罚。本期重点探讨国内医疗器械标签的内容要求。
一、国家药监局抽检凸显标签合规的重要性
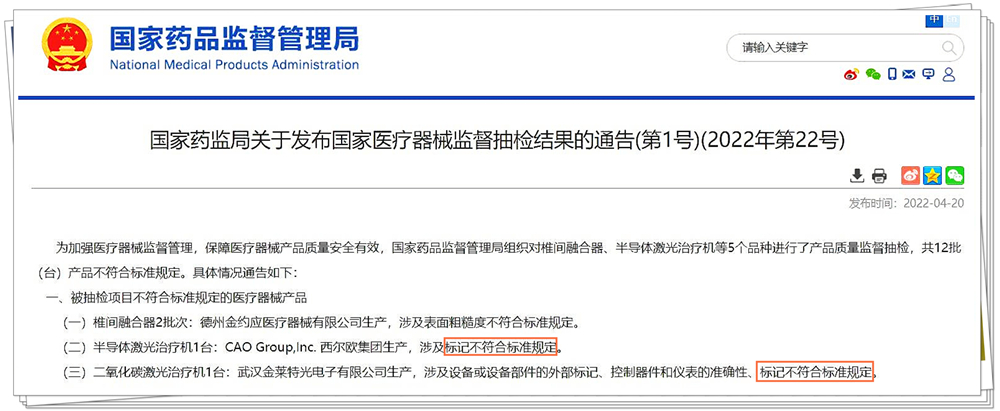
去年国家药监局发布的一次国抽结果(如上图)显示:许多医疗器械的不合格集中表现为产品标识标签不合格,这也说明不少医疗器械生产厂家并未意识到标识标签的重要性,对标签的合规意识不强。
但是,制造商应该清晰认识到:产品使用者难以像厂家那样对产品具备足够的了解和知识,制造商看来极其简单的信息,对使用者而言却可能是严重缺失的。而使用者能够获得产品信息的唯一可靠渠道就是产品的随机文件和标识标签。
那么,对制造商来说,到底如何才能做到标识标签合规?这是厂商技术部门和合规部门需要严肃面对的问题!
二、国内医疗器械标签内容的常规要求
- 产品名称、型号、规格;
- 医疗器械注册证编号或者备案凭证编号;
- 注册人或者备案人的名称、住所、联系方式,进口医疗器械还应当载明代理人的名称、住所及联系方式;
- 生产企业的名称、住所、生产地址、联系方式及生产许可证编号或者生产备案凭证编号,委托生产的还应当标注受托企业的名称、住所、生产地址、生产许可证编号或者生产备案凭证编号;
- 生产日期,使用期限或者失效日期;
- 电源连接条件、输入功率;
- 必要的警示、注意事项;
- 特殊储存、操作条件或者说明;
- 根据产品特性应当标注的图形、符号以及其他相关内容;
- 使用中对环境有破坏或者负面影响的医疗器械,其标签应当包含警示标志或者中文警示说明;
- 带放射或者辐射的医疗器械,其标签应当包含警示标志或者中文警示说明。
注意:医疗器械标签因位置或大小受限而无法全部标明上述内容的,至少应当标注产品名称、型号、规格、生产日期和使用期限或者失效日期,并在标签中明确“其他内容详见说明书”。
三、国内医疗器械标签的合规要点
首先,最基础的是应当遵循法规的要求,即《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号),相关要求请见前文。
然而,除了以上法规的最低要求外,还应当遵循产品相关的标准和指南。
此处做举例说明↓
有源医疗器械
大部分有源医疗器械使用电能源,因此安规和EMC的标准通常可适用。
例如:常规的电气类医疗器械通常应当遵守GB9706.1和YY 0505,如果产品有特殊要求还应当遵循相应该系列标准的-1并列标准和-2专用标准。如果是实验室设备,则应当遵守GB4793.1和GB/T18268.1
相应标准对有源产品的标记标签有具体要求,例如:
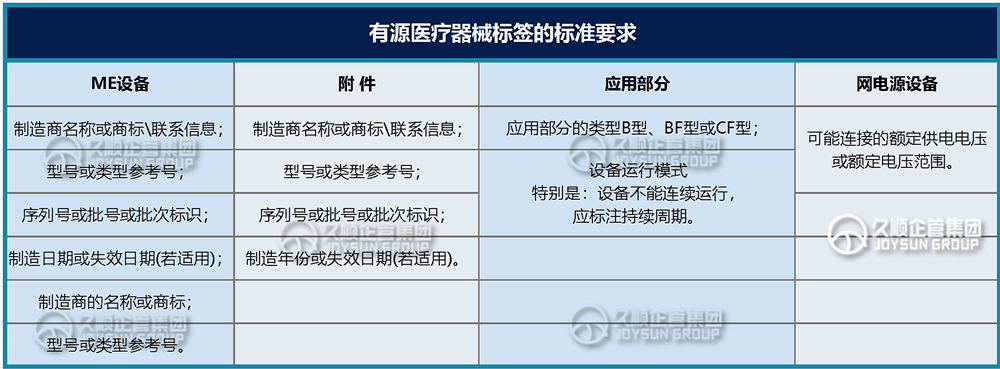
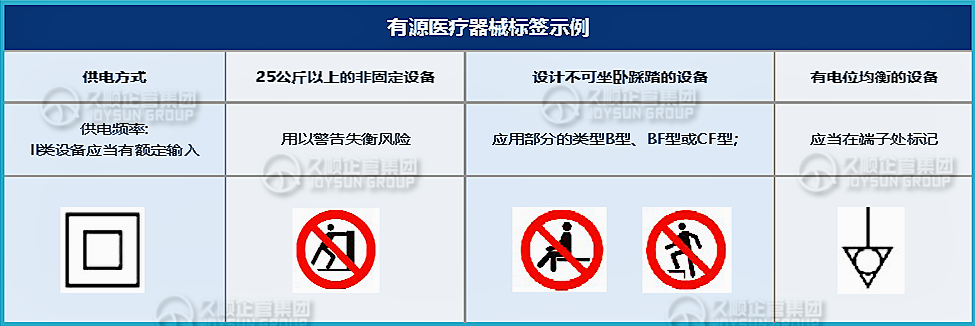
注意:以上是部分常用的有源设备标识标签要求,对于具体设备还应当根据产品的具体特性,应用不同标签,例如:静电敏感、射频、高压部件等。
#解决注册问题当然选资深助手,久顺为您排忧解难#
>> 敬请联络【久顺企管集团】从业近30年的资深合规专家,擅长办理产品注册证、生产许可证、经营许可证、临床试验、质量体系GMP等,具备优厚的咨询管理和技术服务经验及能力,深耕无菌、非无菌、植入、有源、体外诊断等医疗器械领域,中国\荷兰\美国\英国均设公司,护航产品全球范围畅行无阻。





