FDA关于UDI的重要邮件提醒
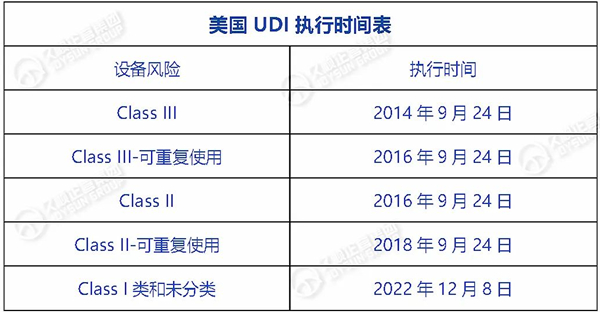
此前,美国已强制要求:2022年12月8日以后,所有医疗器械产品向FDA GUDID提交产品数据并包装上具有UDI载体。
最近,美国食品和药物管理局FDA发送有关唯一器械标识(UDI)合规性和上市要求的电子邮件。
邮件中提及:FDA发现全球唯一器械识别数据库(GUDID)所上传的器械清单和UDI信息存在差异,并且AccessGUDID发布的全球医疗器械命名(GMDN)术语代码及字段出现使用错误、失效情况。
由此,FDA提醒企业:
制造商应审查其GUDID数据库信息,以确保使用准确、有效、未过时的GMDN术语代码或PT代码。
FDA将核查全球唯一器械识别数据库(GUDID)数据,要求制造商更新提交给GUDID的信息,更新应在2023年7月底前完成。
全球唯一器械识别数据库(GUDID)
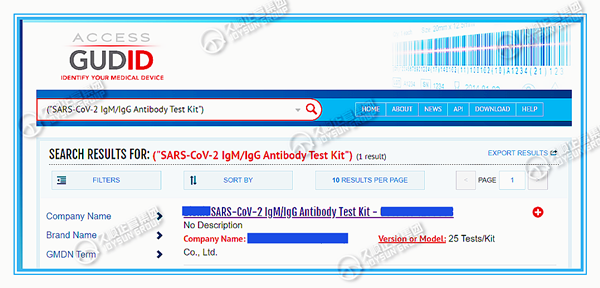
FDA建立的全球UDI数据库(GUDID Database),可供公众查询以获得相应器械的信息。
公众可直接在AccessGUDID网页输入包装标签信息中的DI找到产品信息,还可通过相应字段信息搜索(例如:公司或商品名称,通用名称或者器械型号、版本等)。
制造商如何准确、快速地建立FDA-UDI及GUDID上传?
久顺企管用真实成功案例为你解答↓
案例 ①
申请人:国内某知名医疗器械企业。
GS1: 该企业已申请获得GS1厂商识别号。
邓白氏码:该企业未获得邓白氏码。
久顺完成速度:美国FDA-UDI数据库账户申请+数据上传耗时5个工作日。
久顺解决方案:该企业有一笔订单需出口美国,其获悉需申请FDA-UDI数据库并且上传产品DI信息。久顺企管得知客户未获邓白氏码这一申请中的重要信息,于是加班加点申请,并与国内华夏邓白氏进行深度沟通,仅仅1周便完成邓白氏码申请,并同样在1周内完成FDA-UDI数据库账户申请及数据上传。
案例 ②
申请人:香港某医疗器械企业,以其美国公司名义申请。
GS1: 该企业已申请获得GS1厂商识别号。
邓白氏码:该企业已获得邓白氏码。
久顺完成速度:美国FDA-UDI数据库账户申请+数据上传耗时5个工作日。
久顺解决方案:该企业申请FDA-UDI数据库账户所需的基本信息齐全,但是其存在美国公司、香港公司以及代加工企业等多个企业合作,关系复杂。该企业也一直很担心此类情况是否可申请美国FDA-UDI数据库账户,该案例实属“疑难杂症”。考虑到企业的急迫需求与实际情况,经过久顺企管专业分析与指导,并加班加点申请,只用1周就完成UDI数据库账户申请及数据上传,再次刷新久顺FDA-UDI数据库及上传速度记录。
为使客户出口免受影响,久顺在操作完毕后会将GUDID数据库后台信息下载发给客户,并有多重附加好礼赠送:
1.GUDID账户操作指南(久顺编制中英文版)
2.上传在线视频培训
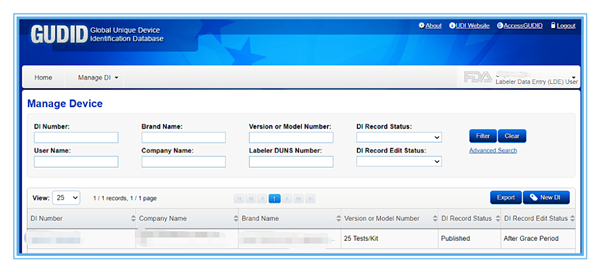
作为资深美代公司,久顺企管已成功为多家客户操作GUDID申请、产品UDI信息上传(因受限于篇幅,以下仅展示部分成功案例):

UDI创建难度不小:不用慌张,有久顺!
FDA UDI数据库申请和提交过程繁琐,操作难度不容轻视,械企可放心交由久顺企管操作。久顺是国内少数几家、获FDA官方授权操作GUDID及UDI的美代公司。
针对美国UDI-DI创建、GUDID数据库账户创建、产品UDI信息输入GUDID数据库等,久顺提供高性价比贴心服务,同样的费用、更优的服务,却只要更少的时间:全系列流程完成最快只需15个工作日,时效与精准兼备足以傲视业界。
以下是久顺服务内容和时间表↓
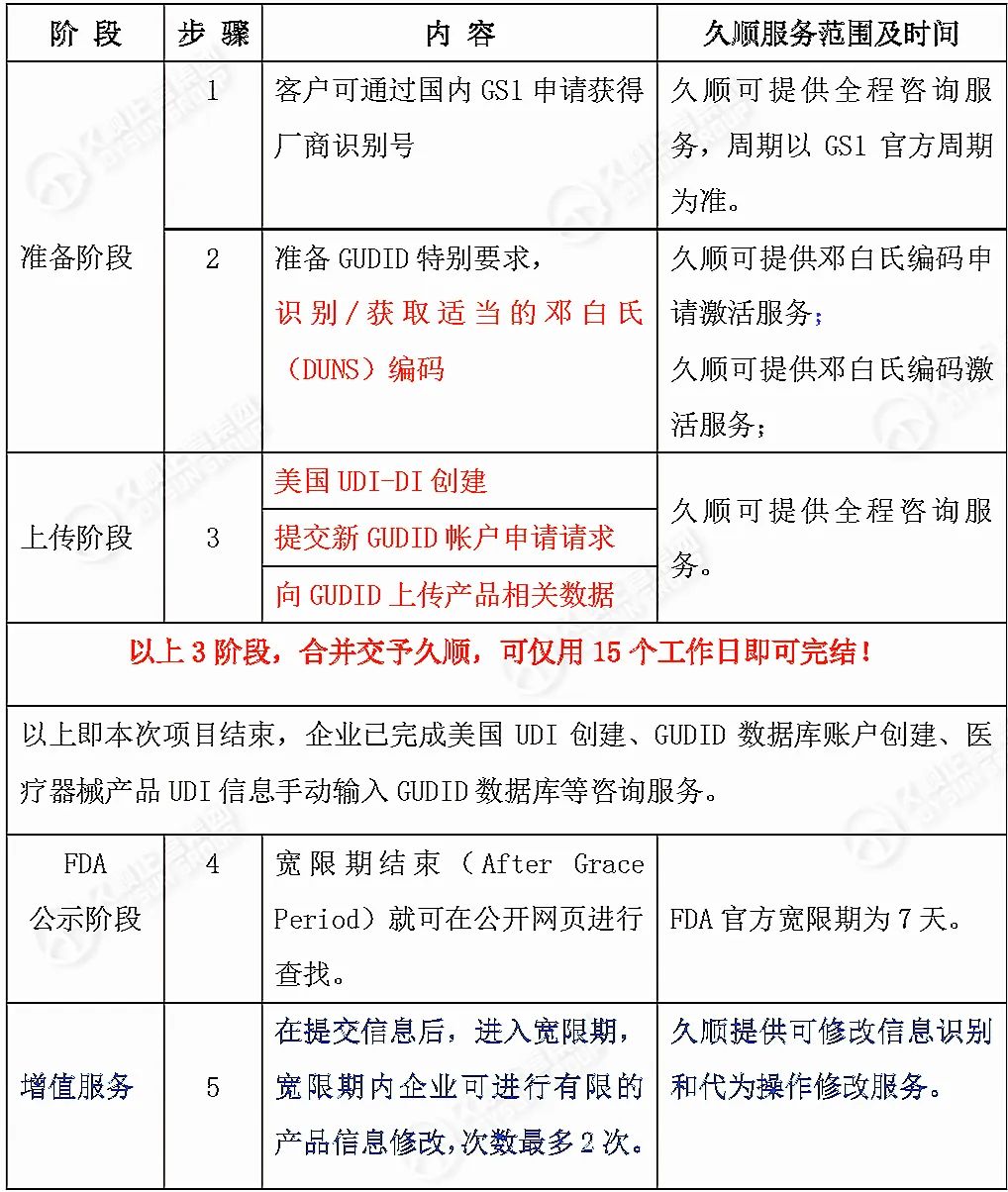
备注:如遇国外节假日会适当顺延。





