一、注册流程
一类产品:由于该类产品风险较低,我国药监局对其采取备案管理,流程和资料要求相对简单,在此不作详述。
二类产品:
①注册申报:申请企业编写申报资料,递交至省药监局,受理窗口在5个工作日内决定受理或补正。
②技术审评:受理之日起3日内,申请资料被转交至技术审评机构进行审评。第二类审评时限为60个工作日,如果出现发补,补正资料应在1年内提交,申请资料补正后的技术审评时限为60个工作日。
(医疗器械注册申请受理后,审评中心应当同步通知相关省药监局启动体系核查,并在接到核查通知后30日内完成核查,且核查情况将被反馈至审评中心)。
③注册证颁发:受理注册申请的管理部门应当自收到审评意见之日起20日内作出决定,并于10个工作日内颁发、送达注册证。
④生产许可证颁发:获得注册证后,医疗器械生产资料被递交至省药监局,并在30个工作日内完成审核,并于10个工作日之内颁发生产许可证。
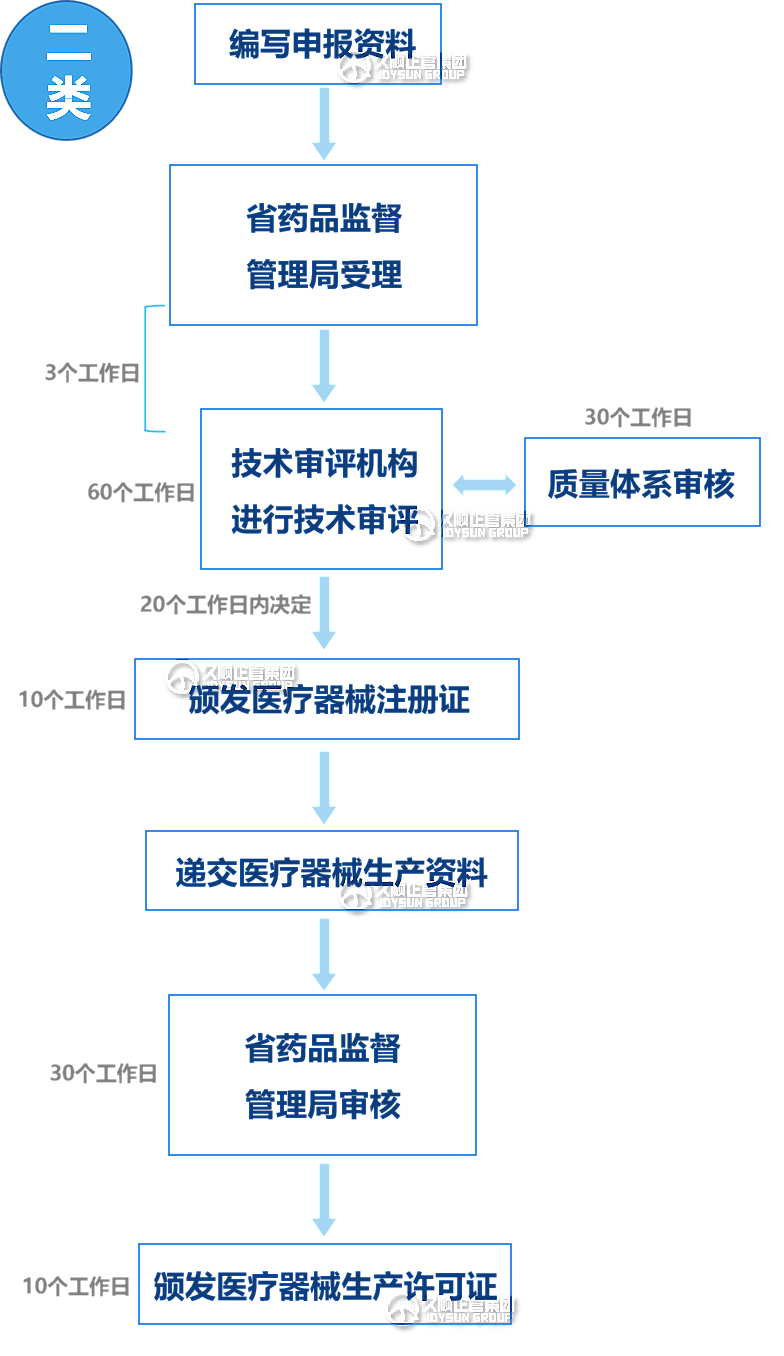
三类产品:基本流程内容与二类产品近似,主要区别在于审核机构(三类为国家药监局)和技术审评时限(三类为90个工作日)
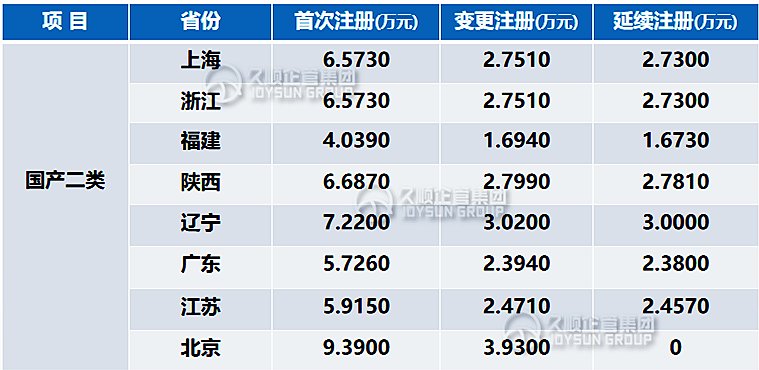
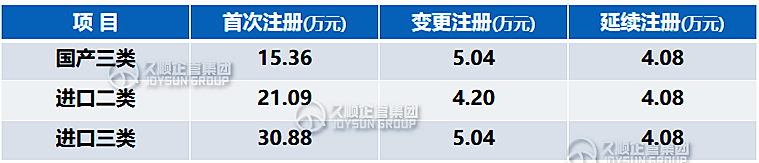
二、注册费用
以下为久顺整理统计的国家局和各省局收费标准,费用并非一成不变,因此仅作参考,省份之间存在费用差异,具体收费需同各地方省局确认。
三、注册资料
根据2021年第121号《医疗器械注册申报资料要求》 中的申报资料目录,本文按照目录顺序,重点讲解较容易发生问题的部分注册资料(注意事项):
1.监管信息 1.2申请表
- 应附资料按照规定的word格式进行上传,PDF格式无法上传;
- 申请表的信息与注册资料的信息应保持一致,如:结构组成、适用范围等;
- 申请人住所,与营业执照保持一致;
- 生产地址,如果已经获得生产许可证,需要同生产许可证保持一致;如果为新的生产企业,则为样品试制的生产地址;
- 进口注册与以上同理,住所与生产地址需要与证明性文件上的地址保持一致;
- 申请人住所和联系人电话必须可收件、可联系,国家药监局的纸质资料快递收件人信息默认为联系人信息,地址和电话如无法取得联系,可能会浪费许多不必要的时间。
住所填写案例分享:某进口注册企业,其实际的办公地址并非营业执照的地址,营业执照所填地址根本无人收件,证件邮寄时联系人当时在国外、未收到邮政快递通知,因此邮政就被直接寄回到寄件地址。之后联系药监局修改收件地址,还需办理地址修改的申请流程,颇费周折之后又恰逢上海封控,总共耽误了4个月才收到注册证书。
1.6申报前与监管机构的联系情况和沟通记录
(1)列出监管机构回复的申报前沟通情况;
(2)既往注册申报产品的受理号;
(3)既往申报前沟通的相关资料,如:既往申报会议前提交的信息、会议议程、演示幻灯片、最终的会议纪要、会议中待办事项的回复,以及所有与申请相关的电子邮件;
(4)既往申报(如自行撤销/不予注册上市申请、临床试验审批申请等)中监管机构已明确的相关问题;
(5)在申报前沟通中,申请人明确提出的问题,以及监管机构提供的建议;
(6)说明在本次申报中如何解决上述问题。
概括:主要为注册申报资料,包括注册前咨询、技术审评补正意见的咨询等沟通情况,发补的情况说明、发补提出的问题、问题对应的解决办法等。
建议:由于审评机构需同时处理许多项目,无法确保对所有项目的沟通情况都能做到记录详实,因此注册企业在上传沟通记录时应尽力做到详细,避免信息差。
如果申报产品与既往注册申报产品相关,则需要提供既往注册申报产品的受理号。
(未完待续,下期再见!)
#产品国内注册要快&还要好?认准久顺就对了!#
>>【久顺企管集团】医械注册的加速引擎!近30年全球合规技术专家,中国\荷兰\美国\英国均设公司,擅长产品注册全程辅导、技术文档编写、质量体系建立完善及咨询等服务,以及CE/FDA/UKCA/CFS等证书办理,具备优厚的咨询管理和技术服务经验及能力,护航产品全球范围高速畅行。





