1.什么是欧洲医疗器械命名系统(EMDN)?
根据欧盟医疗器械MDR 2017/745第26条和体外诊断医疗器械IVDR第2017/746第23条,欧洲医疗器械命名系统(European Medical Device Nomenclature ,简称EMDN)旨在支持欧洲医疗器械数据库(EUDAMED)的运作。EMDN将被制造商用于EUDAMED中注册医疗器械,并在其中同每个唯一设备标识符(UDI-DI)相关联。
由于EMDN主要用于支持MDR和IVDR所要求的监管目的,因此在以下方面发挥着关键作用:
·MDR/IVDR设备文档和技术文档;
·由公告机构进行的技术文档抽样;
·上市后监督、警戒和上市后数据分析等。
EMDN旨在支持所有参与者在MDR/IVDR下开展的活动,并向患者提供其自有器械、已上市并在EUDAMED中注册的所有其他器械的关键描述。
2.EMDN是如何产生的?
根据欧盟委员会和欧盟监管机构在医疗器械协调小组(MDCG)中制定的标准和要求,并基于MDCG提供的方向,EMDN在欧盟委员会发出通知后建立,该通知表明使用意大利卫生部的“国家医疗设备分类(CND)”作为未来EMDN的基础。
3.EMDN的主要原则是什么?
EMDN基于欧盟委员会和欧盟监管机构共同制定的基本原则,包括但不限于:
a.监管机构主导:监管机构在管理、验证、命名系统更新与建议方面发挥着关键作用。
b.结构化:命名系统具有透明的层次结构,由此术语和代码可以被有意义地分组和分类。
c.可预测:结构和内容保持足够的稳定性,以使得命名系统可用于各类监管,其方式仍可适应技术创新。
d.透明度:命名系统术语和描述的政策更新是合理的,并反映监管机构和更广泛的医疗保健群体的需求。
e.包容性:定期审查对所有人开放,并基于现实世界的使用和可证明的需求。
f.可用性:所有用户均可完整地使用术语、描述和代码。
g.可获得性:与其他经营者相比,在使用命名系统时制造商或自然人/法人无需支付费用或遭受区别对待。
h.国际化:在MDR/IVDR申请之日获得国际认可。
4.如何访问EMDN?
所有利益攸关方都可以免费完整访问EMDN。因此,非详尽的利益相关者列表中的制造商、患者、研究机构、从业者、医院、药房等均可以访问EMDN。pdf和excel格式的EMDN可通过欧洲委员会的MDCG文件网页进行访问和下载。
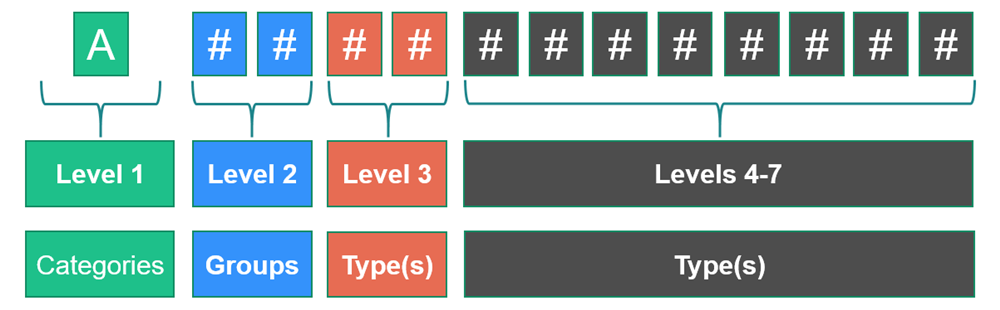
5.EMDN是如何构成的?
EMDN的特点是其在七级层次树中建立的字母数字结构,其将医疗器械分为3个主要级别:
·类别:第1个层次级别,
·组:第2个层次级别,
·类型:第3个层次级别(必要时可扩展为若干个详细级别:1、2、3、4和5)。

每个字母数字代码以1个表示设备所属“类别”的字母开头,后面跟着2个表示“组”的数字和一系列表示“类型”的数字。最大位数设置为13。
6.应该使用哪个级别的EMDN为器械分配术语?
使用EMDN的树状层次结构,用户必须始终为其器械分配最细粒度和最终端的可用术语(树中的最低级别)。
EUDAMED是产品成功出口的关键,制造商别再拖延上传!
重要提醒:制造商和进口商应当尽快完成EUDAMED数据库中角色注册和UDI/产品注册,以避免给您的潜在压力期限。
√EUDAMED经济运营商注册、欧盟UDI-DI申请、EUDAMED数据库上传及指导、UDI相关质量体系建立与维护 →欢迎联系【久顺企管集团】获取专业高效的无忧服务!始创于1996年,荷兰、西班牙、英国、美国、中国均设公司,近30年全球合规技术专家,全程高效的欧盟合规服务:CE注册取证、技术文档编写、合规策略、体系辅导、上市后监督咨询、近20年资深欧代、临床方案设计\临床试验方案编撰、收集\整理\分析试验原始数据并出具临床试验报告等。








 沪公网安备 31011502005499
沪公网安备 31011502005499