1. 医疗器械
指制造商计划单独或组合用于以下一种或多种特定医疗目的的仪器、设备、器具、软件、植入物、试剂、材料或其他物品,包括如下:
·疾病的预测、预防、诊断、监测、治疗或缓解;
·损伤或残疾的诊断、监测、治疗、缓解或弥补;
·解剖结构或生理或病理过程或状态的调查、更换或修改;
·通过对来自人体的标本进行体外检查以提供信息,包括器官、血液和组织捐献,并且该标本无法通过药理学、免疫学或代谢手段在人体内或人体上实现其主要预期作用,但可以通过前述方式帮助其发挥作用。
2. 医疗器械附件
指本身并非医疗器械,但其制造商计划与一种或多种特定医疗器械一同使用的物品,以使医疗器械能够按照其预期用途使用,或直接地协助医疗器械的医疗功能达到其预期用途。
3. 医疗器械分类
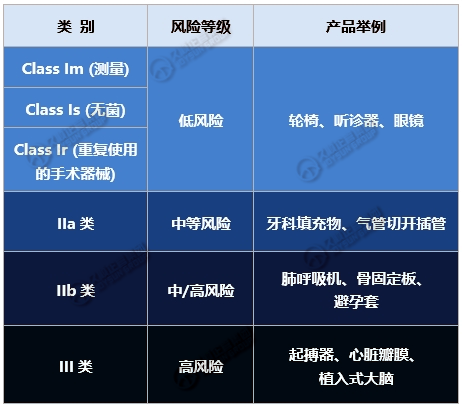
4. 有源器械
指操作依靠人体或重力产生以外的能量来源,并且其通过改变该能量的密度或转换该能量而发挥作用。但是,用于在有源器械和患者间传输能量、物质或其他元素而无任何显著变化的器械不得视为有源器械,软件应被视为有源器械。
5. 植入器械
指部分或全部吸收的器械,其目的是:
· 完全进入人体;
· 更换上皮表面或眼睛表面;
· 通过临床干预并计划在手术后保持原位,任何旨在通过临床干预部分引入人体并计划在手术后保持原位至少 30 天的器械应被视为植入式器械。
6. 侵入性器械
部分或全部通过体腔或身体表面渗透到体内的器械。
7. 通用器械组
具有相同或类似预期用途或技术通用性的一组器械,允许它们以不反映特定特征的通用方式进行分类。
8. 一次性使用器械
旨在单次操作过程中用于单人的器械。
→欧盟CE拿证,认证久顺准没错!
√选择久顺就是选择成功!始创于1996年,西班牙\荷兰\英国\美国\中国均设公司,近30年全球合规技术专家。提供全程高效的欧盟合规服务:√CE注册取证√技术文档编写 √合规策略 √体系辅导 √上市后监督咨询 √近20年资深欧代 √编撰临床方案设计\临床试验方案 √收集\整理\分析试验原始数据并出具临床试验报告等。
久顺部分CE成功案例(篇幅有限,仅展示部分)↓
☑辅导优思达生物取得核酸检测领域首批CE-IVDR证书、获国内核酸检测首张IVDR荷兰CIBG注册证书;
☑辅导江苏宏微特斯的HCG早早孕自测试剂盒取得BSI签发B类CE-IVDR证书;
☑辅导全球医械巨头获IIb类产品CE-MDR证书;
☑辅导斯瑞奇获I类灭菌创口贴CE-MDR证书;
☑助力海翔药业取得I类灭菌CE-MDR证书;
☑助力台衡精密测控获I类测量CE-MDR证书;
☑辅导亚美斯特(天津)获得IIa类通气类产品的CE-MDR证书;
☑辅导杭州某生物企业成功通过I类灭菌采样拭子的MDR体系审核(ISO13485);
☑助力深圳客户顺利通过IIa类敷料类产品的MDR体系审核(ISO13485);
☑辅导某跨国医疗器械企业取得IIb类监护类产品CE-MDR证书
☑辅导老客户IIa类手术器械获得莱茵签发的CE-MDR证书...








 沪公网安备 31011502005499
沪公网安备 31011502005499