世界卫生组织生产预认证(WHO prequalification),行业内简称为PQ,是世界卫生组织2001年建立的针对抗艾、抗疟等产品的评审程序。PQ受理范围现已扩大至生殖保健药品MCD、活性原料药API、成药FPP、疫苗FVP、免疫器械IMD、媒介控制产品VCP、媒介控制原料VCAI、体外诊断试剂IVD等产品。
参与PQ认证的优势有:跻身联合国认可的采购供应商;WHO的一次性审评可用于产品在多个发展中国家上市,市场准入效率得以大幅提升;参与PQ预认证可获得专家顾问的协助,从而有利于企业质量体系迅速提升至国际水平。
现场检查属于PQ认证的关键过程,主要涉及:评估制造商质量管理体系(QMS)及制造实践是否符合国际标准,本期深度解读PQ现场检查的要求。
一、PQ认证适合的产品范围
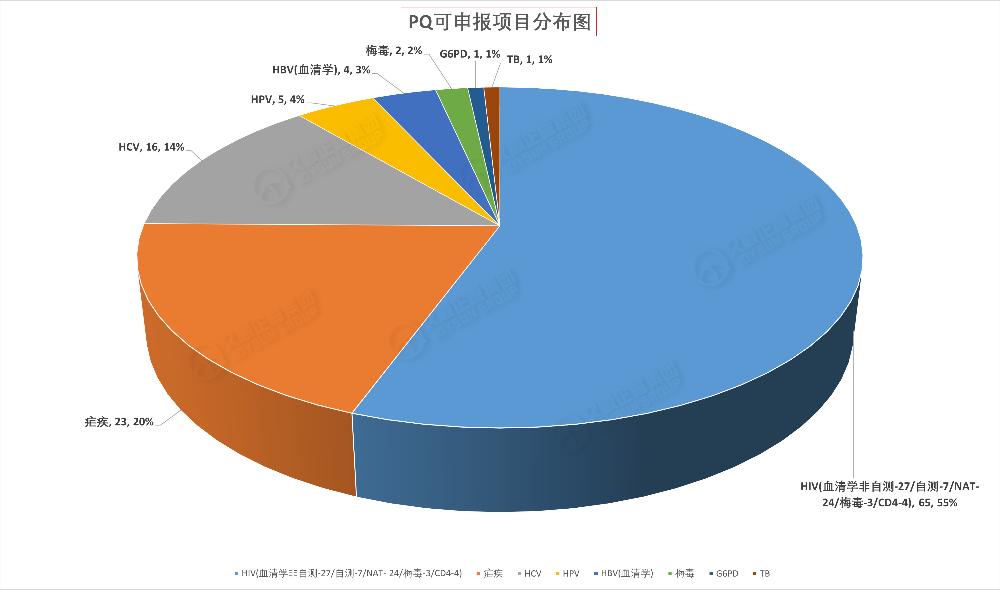
PQ可申报项目涵盖:HIV、HCV、HBV、HPV、G6PD、霍乱、疟疾、梅毒等疾病。
·HIV有关产品共65款 (血清学非自测27、自测7、NAT 24、HIV/梅毒3、CD4 4):约占总数55%;
·疟疾有关产品共计23款:约占总数20% ;
·HCV有关产品共计16款 (血清学非自测10、自测1、NAT 5):约占总数14%;
·HPV有关产品共计5款:约占总数4%;
·HBV有关产品共4款(血清学产品):约占总数3%;
·梅毒产品2款:约占总数2%;
·G6PD有关产品1款:约占总数1%;
·TB有关产品1款:约占总数1%。
二、PQ现场检查的要求
1.制造现场检查的目标
总体目标为评估商用IVD的安全性、性能和质量。具体目标是评估制造商质量管理体系QMS和制造实践是否符合国际标准,详细内容如下:
·确定实施的质量管理体系在符合适当质量标准方面的有效性;
·核实所提交的产品档案及预提交表中支持声明的数据。
2.制造现场检查的范围
仅限于同制造商商定的制造现场和产品,包括与产品关联的全部组织单位、活动、流程。
检查限于检查组所分配的时间,并在检查前与制造商商定。
检查属于抽样过程,换言之:并非检查全部的制造商质量管理体系细节。检查员将从其专业角度选择代表高质量IVD生产工艺的检查内容。
检查时制造现场必须正积极生产至少1种或部分正进行资格预审评估的产品,由此便于检查小组对制造现场实施充分检查。
制造商关键人员必须于检查时在场,确保检查小组能够进入与上述产品生产相关的全部区域并查阅相关文件。
3.现场检查的方式与原则
·基于风险:所有检查都应被规划和执行,监督检的情况下检查的频率和详细程度应考虑到所制造产品的性质和各工厂的合规历史记录。
·运用国家药品监管机构根据同等标准和严格程度运作的经验:若世界卫生组织能够获得满意、最新、相关、可靠的合规证据,则在规划现场检查时将考虑该情况,并可免除或推迟检查。
·与监管合作伙伴的合作执行:
a.最大限度利用稀缺的国际检验资源;
b.利用国际检验经验和专业知识;
c.最大限度提高检查结果的实用性;
d.尽量减少被检查者的监管负担。
e.对申请列入WHO资格预审评估实验室的实验室开展审计。
4.其他类型的检查
·生产现场的后续检查:验证制造商或QCL(质量控制实验室)是否已实施纠正和预防措施;
·生产现场的常规监督检查:验证其持续的质量管理体系和制造实践是否符合国际标准;
·生产现场的特殊(因故)检查:重点关注导致检查的具体原因(警报/投诉等);
·对性能评估实验室的审计:验证其性能是否符合特定IVD测试的国际标准。
久顺可提供世界卫生组织生产预认证PQ辅导咨询服务,具体有:预认证文档编制、体系建立与维护的辅导与陪同检查等。







 沪公网安备 31011502005499
沪公网安备 31011502005499