一、目的和范围
Team-NB欧洲公告机构协会发布该共识文件,旨在详细描述制造商可根据法规(EU)2017/746(IVDR)向公告机构(NB)申请体外医疗器械认证的申请前、申请流程。该文件通过审查各个 Team-NB 成员的申请流程和相关文件并在可能情况下协调流程而制定,适用于过渡至 IVDR 的遗留器械、新上市且此前未根据指令认证的医疗器械,也简要介绍了申请流程结束后的认证活动,可使得公告机构能在更短时间内更高效处理申请。
二、认证流程图
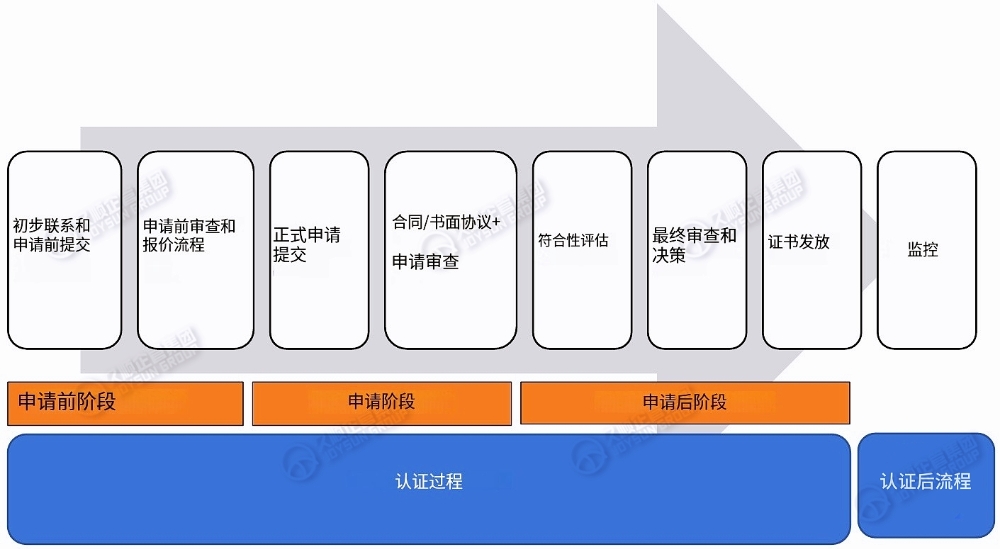
三、初次联系和预申请提交
制造商与 NB 机构之间就合格评定服务的首次接触,联络方式可采用口头或数字(电子邮件、 提交 NB 网站所发布Web 表格),要求 NB提供合格评定服务。NB将要求制造商或其欧盟授权代表提交规定信息,以便于 NB 为其合格评定服务报价。
四、申请前审核和报价流程
制造商提交的申请前信息由NB 审查,以初步验证预申请所包含产品是否属于IVDR监管范畴,且其分类准确与否。根据制造商所提交信息(场地、分包商/供应商、产品等),NB将向制造商提供报价(包含符合性的成本估算)。
五、正式申请提交
如果制造商接受 NB 的报价并准备继续申请程序,其至少应向 NB 提交以下信息:
-根据附录IX §2.1或附录 XI §3.1开展质量管理体系评估的文件。部分NB 可能有补充清单以帮助提交前述文件。
-符合附件IX第II章§4.2的B、C 和 D 类技术文档。
-用于自我检测或近患者检测的设备申请还应包括附件IX第II章第5.1(b)节提及的内容。
-伴随诊断(CDx),应用程序应包括附件IX第II章§5.2(b)的文件。
-D 类器械可能需要额外的文件,以符合欧洲参考实验室(EURL)相关要求。
所有上述文件均应附有表格(如果 NB 有)或信件(正式申请)由制造商签署。
六、合同/书面协议和申请审查
提交申请后, NB将向制造商提供合同文件,包括合同条款和条件,文件涵盖IVDR附件VII§4.3第二小节中的所有要素。一旦双方签署合同,NB根据制造商提供的文件继续审核流程。
根据申请审核情况,NB 将决定是否接受申请或拒绝申请(仅发生在签约后)。
七、合格评定
接受正式申请并签订书面协议后,NB进行申请审查并制定计划,为每个项目制定适当的合格评定活动,包括适用情况下的物理、实验室或其他测试。
合格评定活动的选择取决于器械分类和所选合格评定程序,NB通知制造商合格评定活动预计期间,各分类所需的典型合格评定活动如下:
·A 类:不需要 NB 合格评定,除非在无菌条件下投放市场。
对无菌条件下投放市场的 A 类器械,NB干预仅限建立、确保和维护无菌条件相关方面的审计。
·B 类、C 类和 D 类:需结合质量管理体系(QMS)审核、技术文档评估(TDA)和基于所选合格途径的器械测试。除前述评估外,根据器械性质可能需要采取特定的附加程序/流程。
对质量管理体系评估,在制造商场所进行审核,如有必要则在制造商的供应商和分包商的场所进行审核,NB确定制造商的QMS是否符合法规要求。
根据NB采用的评估模型,与符合要求之间的差距可能被记录为不符合项,制造商必须提供纠正和预防措施计划 (CAPA),并尽职尽责地解决不符合项。根据调查结果的性质、严重性和复杂性及需采取的行动,在NB提出认证建议前,可能需要额外的审计/评估。
八、最终审查和决策
一旦所需的合格评定活动完成,NB就会根据所开展评估活动的结果和建议作最终审查和决策步骤,以颁发证书或拒绝认证,该审查由未参与相关器械合格评定程序的人员执行。
最终审核流程验证以下内容:
-用于决策的报告和支持文件,包括评估期间注意到的不符合项的解决,就应用范围而言是完整和充分的,以及
-不存在未解决的不符合项以阻碍证书颁发。
该审查的有利或不利结果通常反映在内部报告中,作为涵盖认证过程的主要阶段、评估结果的摘要,并通过NB机构的合适人员就是否颁发证书提出建议以作为决策过程一部分。
九、证书颁发
如果决策过程结论为颁发证书,则NB将根据包含IVDR 附件XII中指定信息的适用合规途径生成证书。证书在EUDAMED完全运行后颁发并上传系统。
十、监控活动
初始认证结束时,NB定义了维护所颁证书所需的监控活动。
NB保持最新的监督计划,包括对合法制造商及其分包商/供应商(如果相关)进行年度 QMS审核、PSUR评估、SSP验证、B类和C类器械抽样的技术文件评估、警戒数据评估和突击审计。
十一、语言
技术文档的语言要求和质量管理体系文件语言要求均由NB机构指定。









 沪公网安备 31011502005499
沪公网安备 31011502005499