创新医疗器械审查结果公示
依据国家药品监督管理局《创新医疗器械特别审查程序》(国家药监局2018年第83号公告)要求,创新医疗器械审查办公室组织有关专家对创新医疗器械特别审查申请进行了审查,拟同意以下申请项目进入特别审查程序,现予以公示。
1.产品名称:碳纤维人工肋骨
申 请 人:湖南碳康生物科技有限公司
2.产品名称:经尿道植入前列腺束钉
申 请 人:优诺维(武汉)医疗科技有限公司
3.产品名称:血流导向装置
申 请 人:江苏暖阳医疗器械有限公司
创新医疗器械申请面临哪些难点?
· 有技术创新,并取得专利权或专利使用权;
· 产品已基本定型,且研发数据完整可追溯;
· 产品工作原理处于国际领先水平且为国内首创,其安全性和性能与过往同类型产品相比大有改进;
· 有资料显示,创新医疗器械的审查通过率仅约20%。
创新医疗器械具备什么优势?
· 极大加速医疗器械的审批速度:相关机构将会采取早期介入、专人负责及全程指导的方式,在标准不降低、程序不减少的情况下予以优先审评审批,从而使得企业获得更早上市销售的良机。据统计:创新医疗器械产品的审评较其他产品平均可缩短约83天。
· 促进医疗器械创新发展的重要措施:对鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展起到了积极作用。
· 响应品质医疗的内需提升:物质生活水平的提升伴随着人们对健康的日益重视,对高品质医疗器械的使用意愿也更加强烈。
· 医疗器械创新获得资本市场的青睐:不断迭代的创新吸引诸多投资机会,而顺畅的IPO通道促使越来越多的资本开始关注医疗器械创新。
创新医疗器械审评需提交哪些资料?
首先,该产品分类为二类、三类,但需要在产品进行二类、三类医疗器械首次注册前进行特别审查申请。
申请需填写《创新医疗器械特别审查申请表》,此外还需要提交一系列资料(见下图)。
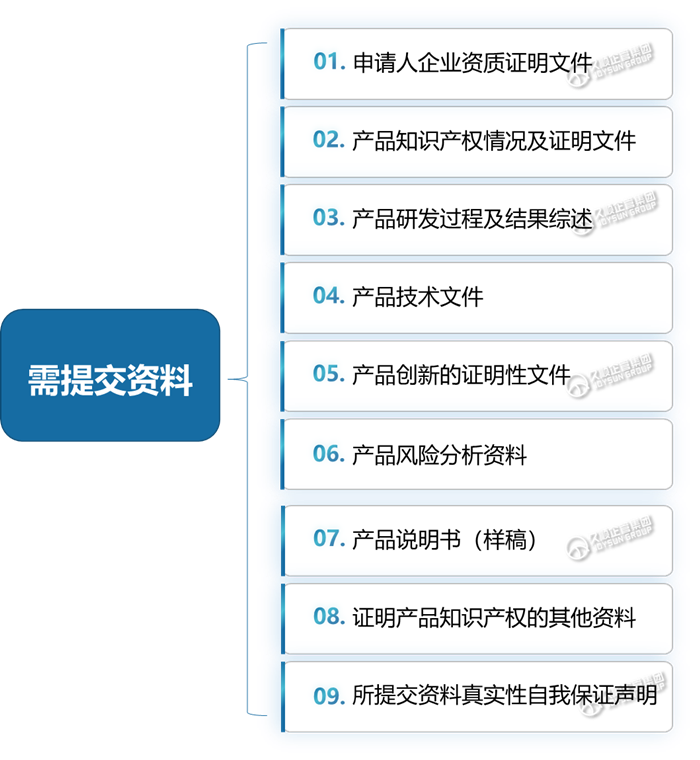
此外,境外申请人还需提交:委托人或境内代理人委托书,代理人或申请人在中国境内办事机构的承诺书及代理人营业执照,或申请人在中国境内办事机构的机构登记证明。
可见,创新器械虽好,但难度也不小!
解决注册问题当然选资深助手,这块工作可考虑交给第三方企业操作。
部分内容来自:国家药品监督管理局医疗器械技术审评中心









 沪公网安备 31011502005499
沪公网安备 31011502005499